Alzheimerin taudin huijaus: zetapotentiaali ja solujen toiminta.
Osa 2
Lääkärin koulutukseen kuuluu kolloidikemiaa. Siellä olemme oppineet, että kun hiukkasia sekoitetaan liuokseen, ne usein leijuvat ilmassa (sen sijaan, että ne uppoaisivat pohjaan tai kelluisivat pinnalle). Tämä johtuu siitä, että jokainen hiukkanen hylkii toisiaan riittävästi, jotta ne erottuvat ja jakautuvat tasaisesti nesteeseen (sen sijaan, että ne paakkuuntuisivat yhteen). Tähän kolloidiseen suspensioon muodostumiseen vaikuttavat suuresti ympäröivät varaukset. Useimmissa elävissä järjestelmissä mitä suurempi negatiivinen varaus, sitä enemmän kolloidit leviävät. Kääntäen, kun zetapotentiaali on heikentynyt, kehon nesteiden komponentit, esim. kapillaarien solut pakkaantuvat aiheuttaen mikrotrombeja.
Yksi merkittävimmistä nestekasautumista on imusuonten verkosto, eli kehon viemäröintijärjestelmän, joka muun muassa poistaa tulehdustuotteita kudoksista, kuten aivokudoksesta. Aivojen imusuonet (lymphatic vessels) ovat erityisen alttiita tälle ongelmalle, sillä niillä ei ole erikoistuneita imusuonia, vaan ne sijaitsevat veri-aivoesteen perivaskulaarisessa tilassa. Tämä rakenne usein vaurioituu neurologisissa sairauksissa, kuten esim. Alzheimerin taudissa, COVID-19:ssä, ja todennäköisimmin COVID-19 piikkiproteiinirokotteen aiheuttamissa vammoissa.
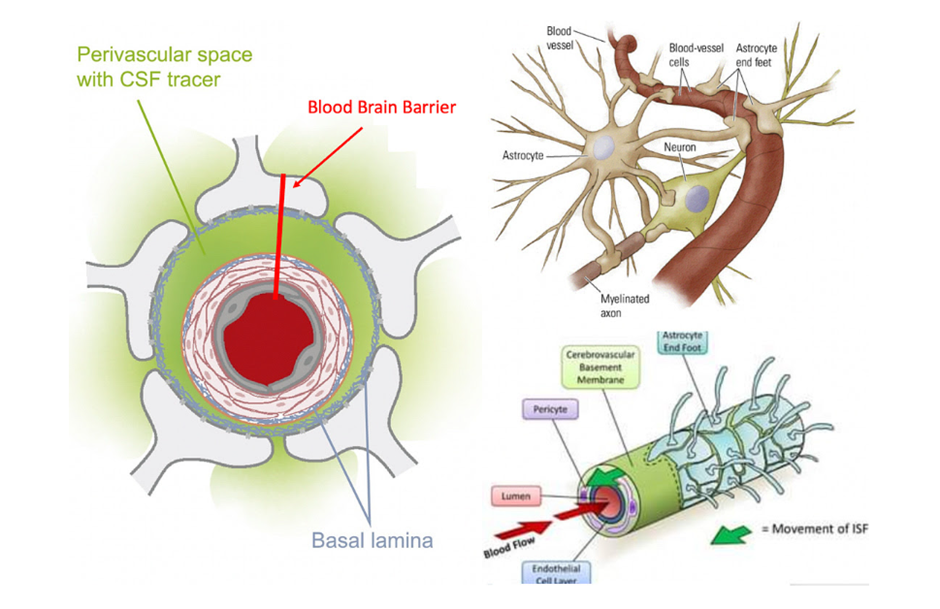
Aivojen glymfaattinen järjestelmä löydettiin vasta 2013. Se on piilossa astrosyyttien jalkojen ja verisuonten seinämien välissä ja laajenee vain yöllä nukuttaessa. Verisuonen ulkoseinät ovat aivolymfakierrolle ainoa pumppu, ja siten erittäin altis lymfan virtausta estävälle imusuonten tukkeutumiselle.
Monet erilaiset neurodegeneratiiviset sairaudet, erityisesti ikääntymiseen ja traumoihin liittyvät, johtuvat glymfaattisen järjestelmän heikentymisestä. Alzheimerin taudissa aivot luottavat tähän järjestelmään poistaakseen tautiin liittyvät neurotoksiset ja tulehdukselliset aineet sekä patologiset proteiinit kuten amyloidit. Esim. unenpuutteen johdosta glymfaattinen järjestelmä ei toimi tehokkaasti ja näin ollen nämä aineet eivät pääse pois aivoa ympäröivästä nesteestä.
Mikä tärkeintä, iän myötä pahenevan kognitiivisen heikkenemisen myötä heikkenee myös ns. zeetapotentiaali. Tämä fysiologinen ilmiö johtunee siitä, että munuaiset menettävät vähitellen kyvyn poistaa haitallisia positiivisia ioneja ja säilyttää hyödyllisiä negatiivisia ioneja. Kun fysiologinen zetapotentiaali heikkenee, myös lymfakierto heikkenee. On ehdotettu, että yksi amyloidin väärinlaskostumisen laukaisevista tekijöistä on zeetapotentiaalin menetys, koska negatiiviset varaukset stabiloivat suspendoituneita proteiineja sen sijaan, että ne paakkuuntuisivat yhteen.
Alumiinin ja Alzheimerin taudin välisestä yhteydestä on puolestaan käyty huomattavaa kiistaa. Negatiivisesti varautuneella amyloidilla on suuri affiniteetti alumiiniin, ja alumiini denaturoi ja saostaa proteiineja erittäin tehokkaasti. Alumiinihydroksidi (AlOH3) on monien rokotusten adjuvantti, joka pääsee makrofagien kuljettamana aivoihin. Se voi aiheuttaa amyloidiproteiinien väärinlaskostumista ja aggregoitumista plakeiksi.
Sydän- ja verisuonitaudeista on virheellisesti väitetty, että kolesteroli aiheuttaa verisuonitukoksia, mutta itse asiassa kolesteroli voi toimia laastarina, joka korjaa jo vaurioituneita valtimoita. Beta-amyloidi voi toimi kolesterolin tavoin. Verisuonten vaurioiden ja kognitiivisten toimintojen heikkenemisen välillä on puolestaan merkittävä päällekkäisyys. Tämä voinee johtua riittämättömästä veren saannista aivoihin, ja molemmilla sairauksilla on monia samankaltaisia syitä, kuten diabetes.
COVID-injektiot aiheuttivat sekä sydänongelmia että kognitiivista heikkenemistä terveillä aikuisilla, ja monissa tapauksissa iäkkäille nopeasti kiihtyvän kognitiivisen heikkenemisen tai dementian. Sama havainto liittyy myös muiden zeetapotentiaaliin haitallisesti vaikuttavien rokotusten käyttöön.
Uni ja dementia
Unenpuutteen tiedetään aiheuttavan aivosumua ja kognitiivista heikkenemistä. Prosessi on erityisen merkittävä ikääntyneillä, joiden tiedetään yleisesti olevan alttiimpia muistinmenetykselle ja kognitiiviselle heikkenemiselle, ja heillä on myös todennäköisemmin unen heikkenemistä.
Unihäiriöt ovat yleisiä Alzheimerin taudissa. Esimerkiksi eräässä tutkimuksessa havaittiin, että seitsemän yleisintä unihäiriötä esiintyi 50,0–65,5 %:lla Alzheimerin tautia sairastavista (mikä oli 2,0–4,46 kertaa yhtä yleistä kuin potilailla, joilla ei ollut Alzheimerin tautia).
Alzheimerin taudissa esiintyvä tau-proteiini on yhdistetty heikentyneeseen unenlaatuun, kun taas β-amyloidi on yhdistetty kyvyn menettämiseen tunnistaa kärsivänsä unihäiriöistä. Syvän unen on osoitettu lieventävän Alzheimerin taudin plakkien aiheuttamaa kognitiivista heikkenemistä. Siksi ei pitäisi olla yllätys, että terveen unen palauttaminen oli Bredesenin ohjelman ydinosa, ja on myös huomionarvoista, että vasta viime vuosina terveellistä unta on alettu pitää keinona ehkäistä dementiaa.
Unilääkkeet estävät palauttavan unen ja lisäävät käyttäjien kuolemanriskiä 2–5 kertaisesti. Useat tutkimukset ovat osoittaneet, että unilääkkeet lisäävät dementian riskiä 17–84 %.
Solujen elämä
Ihmiskehossa on monia järjestelmiä, jotka on suunniteltu muuttumaan ympäristön tarpeiden mukaan, minkä vuoksi esim. painoharjoittelu kasvattaa lihaksia, ja hermosto on hyvin sopeutumiskykyinen.
Millä tahansa hetkellä tiettyjä toimintoja tukevat hermopiirit vahvistuvat, kun taas toiset piirit karsitaan ja lopulta lamautuvat, mikä antaa hermostolle mahdollisuuden sopeutua ympäristönsä monimutkaisiin tarpeisiin. Monet monimutkaiset neurologiset ja psykiatriset häiriöt ovat seurausta siitä, että toimintahäiriöiset neurologiset piirit vahvistavat jatkuvasti itseään.
Jotta näitä sairauksia voitaisiin hoitaa, terveen hermopiirin taakse on luotava momentti, joka on keskeinen syy siihen, miksi on tärkeää omaksua terveet ajatusmallit ja harjoittaa aivoja säännöllisesti aktiivisesti. Keskeinen tapa, jolla aivot saavuttavat tämän sopeutumiskyvyn, on poistaa hermosoluja, joita ei enää pidetä välttämättöminä. Bredesenin teoriassa Alzheimerin tauti johtuu hermosolujen poistamisen lisääntymisestä suhteessa niiden säilyttämiseen, mikä johtaa kognitiiviseen heikkenemiseen.
Bredesenin mallissa amyloidiproteiinilla on keskeinen rooli tässä prosessissa, sillä amyloidin esiasteproteiini (APP) voi jakautua kahteen tai neljään osaan. Jos se jaetaan kahteen osaan, ne suojaavat aivojen neurologista toimintaa. Jos se taas jaetaan neljään osaan, aivojen neurologinen toiminta vaurioituu ja aivosoluja tuhoutuu. Mielenkiintoista on, että APP:n jakautuminen neljään osaan aiheuttaa myös tulevien APP:iden jakautumisen neljään osaan luoden negatiivisen kierteen. Tämän seurauksena Brendenin lähestymistapa keskittyy APP:n palauttamiseen kohti kaksijakoista jakautumista ja samalla tarjoamaan signaaleja, joita kehon solut tarvitsevat selviytyäkseen.
Solujen vaarareaktio (Cell Danger Response)
Solujen vaarareaktio osoittaa, että solut voivat siirtyä ympäristöstressitekijöiden tai taudinaiheuttajien vaikutuksesta puolustavaan aineenvaihduntakiertoon, jossa ne osittain tai kokonaan ”sammuvat”, esim. mitokondriaalinen hengitys ja proteiinisynteesi solussa heikkenevät. Solujen vaarareaktiota havaitaan usein kroonisissa sairauksissa kuten fibromyalgiassa tai lapsuuden rokotusvammoissa (ja COVID-19-rokotevammoissa).
Iän myötä aivojen proteiinisynteesi vähenee merkittävästi, mikä korreloi proteiinien laskostumisen häiriöihin. Usein solujen saamat signaalit johtavat ohjelmoituun solukuolemaan. Kuten Bredesenin malli korostaa, aivojen neuroneilla on ns. riippuvuusreseptoreita, jotka ilman toistuvaa stimulointia käynnistävät kyseisen syklin. Jakautumalla neljään osaan amyloidin esiasteproteiini estää näiden reseptorien stimuloitumisen, mikä laukaisee ohjelmoidun solukuoleman.
Monet muut tekijät voivat myös laukaista neuronien ohjelmoidun solukuoleman. Esimerkiksi verisuoniperäisten aivohalvausten jälkeen monet aivosolut sammuvat, ja jos niitä ei palauteta takaisin (esim. DMSO:lla, kts. Osa III) ne usein kuolevat johtaen pitkäaikaisiin aivohalvausvaurioihin.
Toinen yleinen tilanne, joka johtaa aivosolujen sammumiseen on anestesia. Jotkut aivojen neuronit eivät herää leikkauksen jälkeen. Kognitiivinen heikentyminen voi tapahtua jopa 6kk leikkauksesta. Tämä on ensisijaisesti inhaloitavien anesteettien ongelma, joka voidaan välttää, jos anestesiaan käytetään esim. suonensisäistä ketamiinia tai midatsolamia. B-vitamiinivalmisteella ennen ja jälkeen leikkauksen kognitiivista heikentymistä voidaan vähentää.
Helsingissä 28.11.2025
Tamara Tuuminen, erikoislääkäri, dosentti






