Alkuperäinen englanninkielinen teksti on julkaistu doctors4covidethics.org -sivustolla 3.7.2021. Käännös suomeksi englanninkielisestä tekstistä 23.8.2021: Pelastetaansuomenlapset.fi –kampanjan lääkärit.
Lataa tästä pdf-tiedosto: Asiantuntijalausunto koskien Comirnaty COVID-19-rokotetta lapsille.pdf
Asiantuntijalausunto koskien Comirnaty COVID-19-mRNA-rokotetta lapsille
Michael Palmer MD, Sucharit Bhakdi MD, Stefan Hockertz PhD
Tämän asiantuntijalausunnon esitti italialainen asianajaja Renate Holzeisen oikeusjutussaan, joka haastaa EU:n auktorisoiman Pfizerin mRNA-rokotteen antamisen 12-vuotiaille tai sitä vanhemmille lapsille. Tässä lausunnossa ilmaistut perustelut koskevat erityisesti Pfizerin rokotetta, mutta soveltuvat yhtälailla Modernan mRNA-rokotteeseen, ja niitä voidaan myös soveltaa AstraZenecan ja Johnson&Johnsonin adenovektori-pohjaisiin rokotteisiin.
Tätä dokumenttia saa muuttumattomassa muodossaan jakaa ja levittää vapaasti.
Yhteenveto
Tämä analyysi Pfizerin COVID-19-rooktteen käytöstä (Comirnaty, BNT162b2) nuorilla on jaettu kolmeen osaan, jotka käsittelevät seuraavia kysymyksiä, järjestyksessä:
1. Onko nuorten rokottaminen COVID-19:ää vastaan välttämätöntä?
2. Onko Pfizerin COVID-19-rokote tehokas?
3. Onko Pfizerin COVID-19-rokote turvallinen?
Perustelut, jotka annetaan Osassa 1 koskevat kaikkia COVID-19-rokotteita, kun taas perusteet Osassa 2 ja Osassa 3 koskevat nimenomaan Pfizerin rokotetta.
Osa 1 tulee osoittamaan, että nuorten rokottaminen COVID-19:ää vastaan on tarpeetonta, koska
- tässä ikäryhmässä tauti on melkein aina lievä ja hyvälaatuinen;
- niille harvoille kliinisille tapauksille, jotka vaativat hoitoa, hoito on helposti saatavilla; ∙ immuniteetti taudille on nyt laajalle levinnyt aikaisemman virusinfektion vuoksi (SARS-CoV-2) tai muiden koronavirusten aiheuttamien infektioiden vuoksi; ja
- oireettomat nuoret eivät tartuta tautia ihmisille, joilla saattaisi olla suurempi infektioriski.
Osa 2 tulee osoittamaan, että väitteet tehokkuudesta, jonka Pfizer liittää rokotteeseensa – nimittäin 95 %:n teho aikuisilla, ja 100 %:n teho nuorilla – ovat
- harhaanjohtavia, koska nämä luvut koskevat suhteellista, eivät absoluuttista tehokkuutta, jälkimmäisen ollessa vain 1 %:n luokkaa;
- näennäisiä, koska ne viittaavat mielivaltaisesti määriteltyyn, kliinisesti merkityksettömään arvioinnin päätetapahtumaan, kun sitä vastoin minkäänlaista tehoa ei ole osoitettu vakavaa tautia tai kuolleisuutta vastaan;
- ovat mitä todennäköisimmin vilpillisiä.
Osa 3 tulee näyttämään, että Pfizerin turvallisuusprofiili on katastrofaalisen huono. Osiossa tullaan keskustelemaan siitä, että
- Pfizer, EMA ja FDA ovat systemaattisesti olleet välinpitämättömiä prekliinisistä eläinkokeista saatua todistusaineistoa kohtaan, joka selkeästi osoittaa kohti haittatapahtumien vakavia vaaroja; ∙ Pfizerin rokote on aiheuttanut tuhansia kuolemia viisi kuukautta käyttöönottonsa jälkeen;
- Ne virastot, jotka myönsivät tälle rokotteelle auktorisoinnin käytöstä hätätilanteissa, syyllistyivät vakaviin virheisiin ja laiminlyönteihin tiedettyjen ja mahdollisten terveysriskien arvioinnissa.
Ainoa mahdollinen johtopäätös tästä analyysistä on, että tämän rokotteen käyttöä ei voida sallia nuorilla, ja että sen meneillään oleva käyttö kaikissa ikäryhmässä tulisi lopettaa välittömästi.
1 Nuorten rokottaminen COVID-19:ää vastaan on tarpeetonta
1.1 Mitä saatavilla oleva todistusaineisto näyttää? On olemassa useita todistuslinjoja, jotka osoittavat nuorten rokottamisen COVID-19:ää vastaan olevan tarpeetonta.
1.1.1 COVID-19:n kuolleisuusaste on väestössä matala. Suurin osa kaikista ihmisistä, jotka ovat saaneet COVID-19-infektion, toipuvat vähäpätöisen, usein ei tunnusomaisen taudin jälkeen. Maailman johtaviin epidemiologeihin kuuluvan John Ionnidiksen mukaan |1, 2| COVID-19-infektion kuolleisuusaste on 0.15 – 0.2 %:n luokkaa kaikissa ikäryhmissä, hyvin suurella vääristymällä kohti vanhuksia, erityisesti heitä, joilla on oheissairastavuutta. Tämä kuolleisuusaste ei ylitä sitä, mitä tavallisesti havaitaan influenssaan liittyen, jota vastaan nuorten rokottamista ei ole katsottu kiireelliseksi tai tarpeelliseksi.
1.1.2 COVID-19:n esiintyvyys (prevalenssi) ja vakavuus ovat nuorilla erityisen matalat. Yhdysvalloissa huhtikuuhun 2020 mennessä alle 18-vuotiaiden osuus kaikista COVID-19-tapauksista oli vain 1.7 % |3,4|. Tässä ikäryhmässä kaikkein vakavimmat tapaukset olivat hyvin nuoria vauvoja |4|. Tämä on johdonmukaista, sillä vauvoilla ei ole risti-immuniteettia COVID-19:ää vastaan, mikä muissa ikäryhmissä saadaan altistuessa edeltäville tavallisille hengitystieinfektioille, joita aiheuttavat ihmisiin vaikuttavat koronavirukset (katso osio 1.2.1). Hieman vanhemmilla lapsilla havaittiin poikkeuksellinen hyperinflammatorinen oireyhtymä alkuvuodesta 2020 |5|; ymmärrettävästi näilläkään potilailla ei ollut vielä risti-immunitettia.
Oleellista on, että 10 – 18-vuotialla ei havaittu vakavia COVID-19-tapauksia |4|. Tässä ikäryhmässä oli vain 1 % raportoiduista tapauksista, jotka melkein kaikki olivat hyvin lieviä. Joten nuorilla on erityisen pieni riski saada haittaa COVID-19-infektiosta. Tämän ryhmän rokottaminen on siten tarpeetonta.
1.1.3 COVID-19:ää voidaan hoitaa. Lukuisat kokeneet lääkärit ovat yhteistyössä laatineet tehokkaita hoitosuosituksia kliinisesti osoitetun COVID-19:n hoitoon |6|. Hoitovaihtoehtoja on saatavilla niin taudin aikaisen vaiheen hoitoon, jolloin painopiste on viruksen kahdentumisen (replikaation) estämisessä, ja myöhemmän vaiheen hoitoon, jolloin tulehduksen hoito on tärkeintä. Kaksi lääkettä, joita on menestyksellisesti käytetty aikaisessa vaiheessa, ovat hydroksiklorokiini ja ivermektiini. Molempia lääkkeitä on käytetty ja tullaan jatkossakin käyttämään monissa eri taudeissa. Esimerkiksi Ivermektiiniä pidetään tarpeeksi turvallisena, ei vain kliinisesti osoitetun syyhyn hoitoon – ihon parasiitti-infektio, joka on epämiellyttävä mutta ei vaarallinen – vaan käytettäväksi myös ennaltaehkäisevästi, eli oireettomien syyhyn saaneiden ihmisten kontaktien hoitoon |7|.
Ivermektiiniä käytettään myös laajasti trooppisten parasiitti-infektioiden kuten jokisokeuden (onchocerciasis) hoidossa, ja tästä syystä se on WHO:n elintärkeiden lääkkeiden listalla. Kuitenkin COVID 19-infektion hoidossa WHO katsoo olevan oikeutettua varoittaa tämän saman hyvin tunnetun ja turvallisen lääkkeen käytöstä muualla kuin kliinisissä kokeissa |8|. Tällainen politiikka ei ole rationaalisesti oikeutettua, minkä vuoksi kansalliset ja alueelliset terveysviranomaiset ovatkin täysin asianmukaisesti ohittaneet WHO:n varoitukset, kuten ovat tehneet myös yksittäiset lääkärit ympäri maailmaa.
Tehokkaiden hoitojen olemassaolo mitätöi perustelut rokotusten kiireelliselle käytölle kaikissa ikäryhmissä, nuoret mukaan lukien.
1.1.4 Suurin osa ihmisistä, erityisesti nuoret ovat jo immuuneja SARS-CoV-2:lle. Monien yleisesti käytössä olevien diagnostisten menetelmien luontaisten vikojen ja vajavaisuuksien (katso osio 1.2) vuoksi on mahdotonta tarkasti määritellä, kuinka suuri osa on jo saanut SARS-CoV-2-infektion ja kuinka suuri osa ei ole. Kuitenkin on olemassa merkkejä siitä, että infektion saaneiden ja siitä toipuneiden osuus on suuri:
- Hyperinflammatorisen oireyhtymän esiintyvyys lapsilla (katso osio 1.1.2) oli korkeimmillaan vuoden 2020 puolivälissä ja väheni sitten pienellä viiveellä ensimmäisen COVID-19-hengitystietautiaallon jälkeen |9|.
- Noin 60 %:lla satunnaisesti valituilla koehenkilöillä Brittiläisestä Columbiasta on havaittavia vasta aineita useita SARS-CoV-2-proteiineja vastaan (tästä on Stephen Pelech, University of British Columbia, kertonut henkilökohtaisesti) osoituksena menneestä virusinfektiosta – vastakohtana rokotukselle, joka saisi aikaan vasta-aineita vain yhtä proteiinia vastaan (piikkiproteiinia).
Aikaisemman COVID-19-infektion on huomattu suojaavan hyvin luotettavasti uudelta infektiolta |10|, ja vahva spesifinen humoraalinen ja sellulaarinen immuniteetti huomataan melkein kaikilla parantuneilla henkilöillä, ja myös heillä, joilla ei ollut oireita koko infektion aikana |11|. Niinpä suurella osalla ihmisistä kaikista ikäryhmistä, mukaan lukien nuoret, on jo spesifinen, luotettava immuniteetti COVID-19:lle. Kuten yllä on mainittu, suurin osa heistä, joilla ei ole tällaista spesifistä immuniteettia ovat kuitenkin suojassa vakavalta taudilta risti-immuniteetin vuoksi |12, 13|. Tällainen immuniteetti tulee olemaan erityisen tehokas terveillä nuorilla ja nuorilla aikuisilla. Henkilöt, joilla on spesifinen immuniteetti tai riittävä risti immuniteetti, eivät mitenkään hyödy siitä, että heille annetaan kokeellinen rokotus.
1.1.5 Oireeton COVID-19:n levittäminen ei ole todellista. Usein siteerattu peruste niiden henkilöiden rokottamiselle, joilla ei itsellään ole riskiä saada vakavaa tautia, on tarve saada aikaan ”laumasuoja”; niitä harvoja, joilla on korkea riski, tulisi suojella estämällä viruksen leviäminen väestöön. Tämän perustelun alateksti on ”oireettoman levittämisen” idea – henkilöiden, jotka ovat saaneet infektion mutta joilla ei ole mitään muita merkkejä siitä kuin positiivinen PCR-testitulos, ajatellaan tartuttavan tätä infektiota muille alttiille henkilöille. Jos hyväksymme tällaisen oireettoman levittämisen idean, silloin ennaltaehkäisevä massojen rokottaminen saattaisi todellakin näyttäytyä ainoana luotettavana suojana riskiryhmille.
On kuitenkin yksiselitteisesti saatu selville, että tällaista oireetonta levittämistä ei tapahdu. Suuressa tutkimuksessa, johon osallistui melkein 10 miljoonaa kiinalaista, yhtään uutta infektiota ei voitu yhdistää henkilöihin, joilla oli positiivinen SARS-CoV-2-PCR-testi, mutta joilla ei ollut mitään muita infektion merkkejä |14|. Tämä on linjassa useiden muiden tutkimusten kanssa, joissa verrattiin PCR-testiä viruksen eristämiseen soluviljelmässä niillä potilailla, joilla oli akuutti COVID-19-tauti. Kaikissa tapauksissa viruksen kasvu soluviljelmässä lakkasi, kun oireet lakkasivat, tai hieman sen jälkeen, kun taas PCR-testitulos pysyi positiivisena viikkoja tai kuukausia jälkeenpäin |15, 16|. Tämän vuoksi on ehdotettu käytettäväksi soluviljelmää PCR-testin sijasta määriteltäessä tarttuttavuutta ja arvioitaessa yksilön eristämisen pituutta |16|.
Nämä löydökset viittaavat siihen, että rajoittamalla korkean riskin henkilöiden kontakteja niihin, joilla on parhaillaan tai oli hiljattain akuutin hengitystieinfektion oireita, olisi tehokas ja riittävä suojeleva toimenpide. Umpimähkäinen niiden henkilöiden massarokottaminen, joilla ei ole riskiä saada vakavaa tautia, ei ole välttämätöntä sellaisen suojan saavuttamiseksi.
1.2 Puuttuva näyttö: epätarkkojen diagnostisten menetelmien käyttö. Avainasia, joka puuttuu tämänhetkisestä rokotusten tarvetta koskevasta keskustelusta, on luotettava diagnostinen työkalu sen selvittämiseksi, kenellä on, tai ei ole, ajankohtaista SARS-CoV-2-infektiota. Diagnostinen menetelmä, jota on eniten käytetty tähän tarkoitukseen, perustuu polymeraasiketjureaktioon (PCR). PCR on hyvin tehokas ja monikäyttöinen menetelmä, jota voi käyttää lukuisiin sovelluksiin molekyylibiologiassa, kuten myös virusinfektioiden laboratoriodiagnostiikkaan. Mutta juuri sen tehokkuuden vuoksi, PCR-menetelmää on hyvin vaikeaa käyttää oikein parhaimpinakin hetkinä; se antaa tarkkoja tuloksia vain korkeasti koulutetun ja kurinalaisen henkilöstön käsissä. Se valtava mittakaava, jossa menetelmää on nyt käytetty COVID-19- pandemian aikana, on johtanut siihen, että sitä ovat käyttäneet kouluttamattomat ja riittämättömästi valvotut henkilöt; sellaisissa oloissa massiivinen väärien positiivisten tulosten tuottaminen näytteiden ristikontaminaation vuoksi on katastrofi tulollansa (katso esimerkkiä |17|). Vaikka jo tämä antaa syytä vakavaan huoleen, ongelmat alkavat jo aikaisemmin – nimittäin, jo PCR-menetelmän suunnittelu ja ohjeet, joita käytetään testien tulkintaan, johtavat vääriin positiivisiin tuloksiin jopa taitavien ja huolellisten henkilöiden käsissä. Avainpäätelmä tästä osiosta on se, että PCR-testeiltä, joita on käytetty koko pandemian ajan, ja joita käytetään jatkossakin, puuttuu virheettömyys (accuracy) ja tarkkuus (specificity), eikä niihin voi luottaa diagnostisissa tai epidemiologisissa tarkoituksissa. Jotta voisimme luotettavasti oikeuttaa nämä johtopäätökset, meidän tulee ensin tarkastella menetelmän perusasioita yksityiskohtaisemmin.
1.2.1 Koronavirukset ja SARS-CoV-2. Koronavirukset ovat suuri vaipallisten positiivisten juosteisten RNA virusten perhe. Ihmisissä ja eräissä eläinlajeissa ne aiheuttavat hengitystieinfektioita, joiden vakavuus voi vaihdella lievästä tappavaan. Valtava enemmistö koronavirusinfektioista ihmisillä aiheuttaa lievän taudin (tavallisen flunssan), mutta hyvin pienillä lapsilla, joilta vielä puuttuu aiempi altistuminen, hengitystietauti voi olla vakavampi. Huomioi kuitenkin, että samanlaisen kliinisen taudinkuvan aiheuttavat myös virukset useista muista perheistä, lähinnä rinovirukset. Kolme kliinistä oireyhtymää – SARS, MERS, ja COVID-19 – ovat yhteydessä tiettyihin koronaviruskantoihin, jotka kaikki ovat ”ilmaantuneet” viimeisten 20 vuoden aikana.
Virus, joka aiheuttaa COVID-19-infektion tunnetaan nimellä SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2, suomeksi: vakava akuutti hengitystieoireyhtymä -koronavirus 2). Maailman Terveysjärjestä (WHO) julisti kansainvälistä huolta aiheuttavan kansanterveydellisen hätätilan 30.1.2020 ja pandemian 11.3.2020. Vaikka on pidetty yllä uskomusta, että SARS-CoV-2 lähti liikkeelle luonnollisesti eräästä lepakkolajista |18|, perinpohjaisen SARS-CoV-2:n ja samaa sukua olevien viruskantojen genomisekvenssien analyysi osoittaa yksiselitteisesti, että virus on tosiasiallisesti keinotekoista alkuperää |19-22|. Tämä alun perin ”salaliittoteoriaksi” halveksivasti kutsuttu ajatus on viime aikoina saanut hyväksyntää valtavirran edustajilta.
1.2.2 Polymeraasiketjureaktio. Polymeraasiketjureaktio (PRC) on monikäyttöinen metodi deoksiribonukleiinihapon (DNA:n) biokemiallisen kahdentumisen (replikaation) aikaansaamiseksi koeputkessa (in vitro).
Välittömästi Kary Mullisin keksinnön jälkeen 1980-luvulla, PCR sai valtavan suosion molekyylibiologian alalla. Sille löydettiin sovelluksia DNA-mutaatioiden aikaansaamiseksi, DNA:n sekvensointiin, eri alkuperää olevien nukleiinihappojen sekoittamiseen ja yhdistämiseen (yhdistelmä-DNA-tekniikka), ja uusien nukleiinihappojen luomiseen tai jopa kokonaisten genomien luomiseen tyhjästä (“synteettinen biologia”). PCR löysi tiensä pian myös diagnostisen lääketieteellisen mikrobiologian kenttään |23|. Erityisesti liittyen viraalisiin patogeeneihin, PCR on nyt yksi diagnostisten menetelmien tukipilareista. Tätä taustaa vasten ei ole yllättävää, että PCR-menetelmiä on myös otettu käyttöön SARS-CoV-2:n laboratoriodiagnostiikassa.
1.2.2.1 Toimintaperiaate. Ymmärtääkseen kuinka PCR toimii, on parasta aloittaa palasesta kaksoiskierteistä DNA:ta (hyvin tunnettu kaksoiskierre). Tällaisessa molekyylissä kumpikin parillinen yksittäisjuoste koostuu neljästä erilaisesta rakennuspalikasta (nukleotidista), joihin viitataan tässä lyhenteillä A, C, G ja T. Kummassakin yksittäisjuosteessa nämä rakennuspalikat on järjestetty kuin helmet helminauhassa; nukleiinihapon biologinen aktiviteetti ja identiteetti määräytyvät sen luonteenomaisen nukleotidisekvenssin mukaan.
DNA-kaksoiskierteen kahta juostetta pitävät yhdessä nukleotidien sopiva pariutuminen, siten esim. A yhdessä juosteessa on aina vastapäätä T:tä toisessa juosteessa, ja C toisessa juosteessa on aina vastapäätä G:tä toisessa. Niinpä yhden juosteen nukleotidisekvenssi seuraa toisen juosteen sekvenssiä – sekvenssit ovat toisiaan täydentäviä.
PCR-menetelmän ensimmäiseen askeleeseen kuuluu kahden juosteen erottaminen toisistaan, joka saadaan aikaan kuumentamalla DNA-näytettä ”sulamispisteensä” ohi. Kumpaakin juostetta voidaan nyt käyttää mallineena uuden vastakkaisen juosteen uuden kopion syntetisoimiseksi. Tässä tarkoituksessa kaksi lyhyttä synteettistä yksi-juosteista DNA-molekyyliä (”aluketta”) lisätään; niiden sekvenssit on valittu siten, että yksi kiinnittyy kumpaankin DNA:n mallinejuosteeseen perustuen sekvenssien toisiaan täydentävään luonteeseen. Jotta tämä alukkeiden kiinnittyminen tapahtuisi, reaktion lämpötilaa täytyy alentaa. Kun alukkeet ovat kiinnittyneet, kumpaakin pidennetään yhdistämällä toistuvasti vapaiden nukleotidien esiasteita yhteen sen vapaista päistä. Tähän käytetään lämpövakaata DNA-polymeraasia – bakteerientsyymiä, joka tuottaa DNA:ta. Pidennys tapahtuu lämpötilassa, joka on kaksoisjuosteen erottamiseen ja alukkeen kiinnittymiseen käytettyjen lämpötilojen välissä (”lämpökäsittely”). Kun tämä askel on pidentänyt kumpaakin aluketta uudeksi DNA-juosteeksi, olemme luoneet kaksi kaksoiskierteistä DNA-molekyyliä yhdestä molekyylistä. Voimme nyt toistaa prosessin – erottaa kaksi kaksoiskierrettä ja muuntaa ne neljäksi, sitten kahdeksaksi jne. 10 syklin jälkeen alkuperäisen kaksoiskierteisen DNA:n määrä on kasvanut suunnilleen tuhatkertaiseksi, 20 syklin jälkeen miljoonakertaiseksi, jne. – vahvistaminen (amplifikaatio) jatkuu eksponentiaalisesti reaktiosyklien määrän mukaan, kunnes reaktio on lopulta käyttänyt loppuun kaikki alukkeet ja/tai nukleotidien esiasteet.
1.2.2.2 PCR ja RNA-mallineet. Yllä oleva pohdinta koski vain DNA:ta mutta PRC:ää voidaan käyttää myös RNA-mallineitten kanssa; tämä on tärkeää mitä tulee SARS-CoV-2:een, koska tällä viruksella on RNA:ta DNA:n sijasta geneettisenä materiaalinaan. Tässä tarkoituksessa RNA muunnetaan (”käänteiskopiodaan”) ensin DNA:ksi käyttäen käänteiskopioijaentsyymiä. Viraalisen RNA-genomin DNA-kopiota kutsutaan täydentäväksi DNA:ksi (complementary DNA = cDNA).
1.2.3 PCR-diagnostiikan sovellusten potentiaaliset sudenkuopat. Näimme juuri kuinka PCR mahdollistaa sen, että voimme ottaa hyvin pienen DNA-näytteen ja vahvistaa sitä epätavallisen tehokkaasti. Kuitenkin, tämä vahvistamisen tehokkuus aiheuttaa paljon ongelmia, joita täytyy huolellisesti tarkastella, jotta tuloksista tulisi tarkoituksenmukaisia varsinkin diagnostiikan kontekstissa.
1. Jos käytämme liian suurta määrää reaktiosyklejä, havaitaan olemattoman pieni määrä nukleiinihappoa, millä ei ole mitään diagnostista merkitystä.
2. Reaktiossa käytetyt monet lämpötilat tulee huolellisesti kalibroida ja niiden tulee täsmätä DNA alukkeiden pituuden ja nukleotidisekvenssin kanssa. Jos erityisesti alukkeen lämpökäsittelyn lämpötila on liian alhainen, alukkeet saattavat kiinnittyä malline-DNA-molekyyliin epämääräisellä tavalla – huolimatta yhdestä tai useammasta yhteensopimattomasta nukleotidista – ja muut DNA molekyylit kuin alun perin oli tarkoitettu, vahvistuvat. COVID-diagnostiikan kontekstissa tämä voisi tarkoittaa esimerkiksi sitä, että muiden kuin SARS-CoV-2-koronavirusten nukleiinihapot vahvistuvat, ja niitä luullaan SARS-CoV-2:n nukleiinihapoiksi.
3. Lämpötilan lisäksi muutkin olosuhteet tulee huolellisesti kalibroida, jotta varmistetaan tarkkuus (spesifisyys). Näihin kuuluvat erityisesti magnesiumionien ja vapaiden nukleotidien pitoisuudet; liian suuret pitoisuudet suosivat ei-spesifistä vahvistamista.
Asiaan liittyy myös ongelma, joka ei johdu vahvistamisen tehokkuudesta vaan enemmänkin teknisestä rajoituksesta; PCR on tehokkain, jos vahvistettu DNA-molekyyli ei ole useaa sataa nukleotidia pidempi; kuitenkin täyspitkä koronavirusgenomi on noin 30,000 nukleotidia pitkä. Jos kyetään onnistuneesti vahvistamaan vain usean sadan nukleotidin segmentti, se ei vielä todista, että malline-nukleiinihappo itsessään olisi kokonainen ja ehjä tai että se olisi osa tartuntavaarallista viruspartikkelia.
1.2.4 Tekniset turvatoimenpiteet diagnostisessa PCR-menetelmässä. Ei-spesifistä ja liian sensitiivistä vahvistamista vastaan voidaan suojautua monin tavoin:
1. Kaikki alukkeet, jotka ovat osa samaa reaktioseosta, tulee suunnitella siten, että ne lämpökäsittelyssä kiinnittyvät malline-DNA-molekyliin samassa lämpötilassa. Intuitiivisesti ymmärtänemme, että pidempi aluke kiinnittyy mallineeseensa korkeammassa lämpötilassa kuin lyhyempi; ja koska side, joka muodostuu C:n ja vastapuolella olevan G:n välille on tiiviimpi kuin A:n ja T:n välillä oleva, jokaisen alukkeen nukleotidien kokoonpano täytyy myös ottaa huomioon. Jos alukkeet ovat tältä osin yhteensopimattomia, silloin innokkaammin kiinnittyvä aluke alkaa kiinnittyä ei-spesifisesti, kun lämpötila on tarpeeksi matala sallimaan toisen alukkeen kiinnittyvän spesifisesti. Alkuperäistä Corman-Drosten-PCR- protokollaa |24|, joka sai nopeasti WHO:n hyväksynnän, on kritisoitu juuri tämän virhemahdollisuuden vuoksi |25|.
2. Sen sijaan, että vahvistettaisiin vain malline-DNA:n yksittäistä osaa, voidaan samanaikaisesti vahvistaa useita osia käyttäen sopivaa määrää DNA-alukepareja edellyttäen, että kaikkia osia, tai sopivaa minimimäärää, on onnistuneesti vahvistettu, jotta testistä tulee positiivinen.
3. “Syklin kynnystä” tai lyhyesti Ct-lukua täytyy seurata, mikä tarkoittaa vahvistamissyklien määrää, joka tarvittiin tuottamaan havaittava määrä vahvistettua tuotetta; mitä matalampi syklien määrä, sitä suurempi alkuperäinen malline-nukleiinihapon määrä, jonka on täytynyt olla läsnä.
4. Identiteetin varmistus – tarkka vahvistettujen nukleiinihappomolekyylien nukleotidisekvenssi. DNA sekvensointi on ollut mahdollista tavanomaisissa diagnostisissa laboratorioissa jo huomattavan kauan eikä ole mitään hyvää syytä olla käyttämättä sitä, varsinkin kun väestön terveyteen liittyvät päätökset riippuvat näistä laboratoriotuloksista.
1.2.5 Tosiaikainen PCR. Yllä olevaa kolmoskohtaa, ja osittain myös neljättä voidaan tarkastella käyttäen tosiaikaista PCR:ää. Tässä menetelmässä vahvistetun DNA:n kerääntymistä seurataan samalla, kun reaktio etenee tosiajassa, ja tuotteen määrää mitataan jokaisen syklin jälkeen (määrällinen PCR; quantitative PCR; qPCR). Tosiaikaisia havaintoja voidaan tehdä, kun otetaan mukaan kolmas DNA-aluke, joka kiinnittyy kumpaan tahansa malline-DNA-juosteeseen niiden kahden muun alukkeen väliin, jotka ohjaavat DNA synteesiä. Alavirrassa tuon kolmannen alukkeen kiinnittymiskohdasta säteilee valosignaali, jonka intensiteetti on suhteessa läsnä olevan vahvistetun DNA:n määrään. Koska tämän alukkeen kiinnittyminen vaatii myös täydentävää kohdesekvenssiä DNA-mallineessa, tämä metodi antaa jonkinasteisen varmistuksen kohde-DNA:n nukleotidisekvenssistä.
Toinen yksinkertaisempi tosiaikaisen PCR:n muoto käyttää yksinkertaista värimolekyyliä, joka kiinnittyy kaksoiskierteiseen DNA-molekyyliin. Väri tuo esiin heikon taustafluoresenssin, joka voimistuu dramaattisesti, kun tapahtuu DNA-molekyyliin kiinnittymistä. Mitattu fluoresenssin lisäätyminen on suhteessa vahvistetun DNA-molekyylin kokonaismäärään; mutta koska väri kiinnittyy huolimatta DNA sekvenssistä, tässä tapauksessa signaali ei anna todistetta siitä, että oikeaa mallinne-DNA:ta on vahvistettu.
1.2.6 Puutteet kaupallisissa COVID-19-PCR-testeissä. Valitettavasti vahvistussyklien määrää (Ct-arvo), joka tarvitaan löytääksemme kyseessä olevan geneettisen materiaalin, harvoin sisällytetään tuloksiin, jotka annetaan viranomaisille, lääkäreille tai testatuille. Suurimmassa osassa kaupallisia RT-qPCR-testejä on vahvistussyklien raja, jossa vahvistussignaalia tulisi pitää positiivisena, asetettu 35:ksi tai suuremmaksi. Useat tutkimukset ovat osoittaneet, että Ct-arvoilla, jotka ovat suurempia kuin 30, on hyvin pieni ennustearvo positiivisille virusviljelmille, ja siten myös tartuttavuudelle tai akuutin sairauden olemassaololle |15, 26-28|. Ottaen huomioon, että monissa kliinisissä tutkimuksissa – pitäen sisällään myös Pfizerin tutkimukset (katso myöhemmin) – ”COVID-19-tapaus” tai ”päätetapahtuma” riippuu vain positiivisesta PCR-testistä (ottamatta huomioon Ct-arvoa) ja yhdestä tai muutamasta ei-spesifisestä hengitystietaudin oireesta, emme voi liioitella kelvottoman korkeiden Ct-raja-arvojen käytön merkitystä. Tämä systemaattinen ja laajalle levinnyt virhe on vakavasti vääristänyt diagnooseja, joita on annettu yksittäisille potilaille, ja se on myös vääristänyt pandemian epidemiologiaa kokonaisuudessaan. Lisäksi systemaattinen laiminlyönti koskee myös vahvistetun DNA-fragmentin identiteetin vahvistusta. Vaikka tällaisten fragmenttien sekvensointi Sangerin DNA-sekvensointi-menetelmällä (kultainen standardi) on periaatteessa tehtävissä suuressa mittakaavassa, sitä ei ole rutiininomaisesti käytetty meneillään olevan massa-PCR-testaus-kampanjan mittakaavassa. Virhettä vielä pahentaa; hyvin matala itsenäisten PCR amplifikaatioiden määrä, joka tarvitaan positiiviseen testitulokseen – kahden tai jopa vain yhden on katsottu riittävän useilla hallintoalueilla – ja se myös vahvistuu monenlaisista muista teknisistä virheistä tässä laajasti käyttöön otetussa ja kaupallistetussa Corman-Drosten-protokollassa, jota käsitellään yksityiskohtaisesti muualla |25|.
Yhteenvetona todettakoon, että positiivista RT-qPCR-testitulosta ei voi hyväksyä todisteeksi siitä, että henkilöllä olisi tällä hetkellä tartunta tai että hän olisi tartuttava – ei silloinkaan, vaikka kliininen kuva antaisi sopivaa uskottavuutta tämänhetkisestä COVID-19-infektiosta, ja vaikka sairauden esiintyvyys yhteisössä olisi huomattava. Ensinnäkin, RNA-materiaali, jossa kohdesekvenssit ovat, voisi hyvin olla peräisin ei elinkelpoisista/ei-aktiivisista viruksista; tämä on erittäin todennäköistä, jos kyseessä oleva potilas on jo toipunut infektiosta. Toisekseen, jotta voisi tartuttaa jonkun, täytyisi olla minimimäärä elinkelpoista virusta; mutta tehdyt testit, joilla on liian korkeat (eikä edes raportoidut) Ct-arvot, havaitsevat erittäin pieniä määriä geneettistä materiaalia, josta ei ole mitään todellista riskiä.
2 Pfizerin COVID-19-rokote ei ole tehokas.
2.1 Mitä todistusaineisto näyttää? Pfizer mainostaa itsepintaisesti 95 %:n tehoa rokotteelleen, mikä perustuu kliinisiin kokeisiin, jotka olivat pohjana FDA:n |29| ja Euroopan Unionin |30| myöntämälle kiireelliselle rokotteen hyväksynnälle. Vielä tuoreemmassa tutkimuksessa nuorilla |31| väitettyä tehokkuutta on nostettu, ei vähempään kuin 100 %:iin. Näitä väitteitä ei kuitenkaan voi hyväksyä sellaisenaan.
2.1.1. Absoluuttinen vs. suhteellinen tehokkuus (efficacy). Pfizer/BioNTechin ensimmäisessä raportoidussa kliinisessä kokeessa 43,548 osallistujaa satunnaistettiin ja heistä 43,448 sai injektion. Kokeellinen rokote (BNT162b2) annettiin 21,720 henkilölle, ja 21,728 sai lumerokotteen. Molemmissa ryhmissä yhteensä raportoitiin 170 COVID-19 -“tapausta”, joista 162 oli lumerokotetta saaneessa ryhmässä, kun taas 8 tapausta havaittiin BNT162b2-ryhmässä. Lukuihin perustuen – 8/162 on noin 5 % – Pfizer julisti 95 %:n tehokkuudesta. On kuitenkin selvää, että tämä tehokkuus on vain suhteellinen arvo – absoluuttisin termein, vähemmän kuin 1 % lumerokoteryhmästä kehitti COVID-19-infektion, joten vähemmän kuin 1 % rokoteryhmästä oli suojassa siltä.
Samanlainen tilanne vallitsee myöhemmässä, pienemmässä kokeessa, joka tehtiin 12 – 15-vuotiaille nuorille |31|. Tässä kokeessa rokoteryhmässä oli 1131 nuorta henkilöä, kun taas lumerokoteryhmässä oli 1129 henkilöä, joista 16 sai myöhemmin COVID-19-diagnoosin, kun taas rokoteryhmässä ei ollut yhtään tapausta. Tapansa mukaisesti Pfizer/BioNTech muutti tämän 1,4 %:n absoluuttisen tehokkuuden suhteelliseksi 100 %:ksi; ja vain tämä viimeinen arvo on nostettu esille julkaistun tutkimuksen tiivistelmässä.
2.1.2 BNT162b2:n negatiivinen vaikutus nuorten kokonaissairastavuuteen. Aikaisemmin siteeratussa rokotetutkimuksessa nuorilla COVID-19-”tapaus” määriteltiin seuraavasti:
Vahvistetun COVID-19-infektion määritelmään kuului yksi tai useampi oire (ts kuumetta, uutta tai lisääntynyttä yskimistä, uutta tai lisääntynyttä hengitysvaikeutta, kylmän väristyksiä, uutta tai lisääntynyttä lihaskipua, uutta tai lisääntynyttä maku- tai hajuaistin menetystä, kurkkukipua, ripulia, oksentelua) ja SARS-CoV-2-NAAT- positiivisuus (= positiivinen PCR-testitulos) joko oireellisen jakson aikana tai neljän päivän sisällä ennen tai jälkeen oireiden (testi otettu joko keskuslaboratoriossa tai paikallisessa testauspaikassa käyttäen hyväksyttävää testiä).
Joten yksi ainoa oire ei-spesifisten oireiden listalta plus positiivinen testitulos epäluotettavasta testistä (vrt. osio 1.2.6) katsottiin riittäväksi vahvistamaan diagnoosi. Vaikkakin tutkimuksessa jatketaan useiden vakavaan tautiin kuuluvien kliinisten kriteerien listaamista, se ei anna mitään viitteitä siitä, että kenelläkään koehenkilöllä olisi tosiasiassa ollut niitä. Sen sijaan voidaan olettaa, että koko koepopulaatiossa esiintyi hyvin vähän ei-vakavia COVID-19-tapauksia, eikä yhtään kliinisesti vakavaa tapausta. Suurena kontrastina näille luvuille, jotka liitetään sairauteen ja jolta rokotteen on otaksuttu suojelevan, rokotuksen sivuvaikutukset olivat erittäin tavallisia. Sen lisäksi, että injektiokohdan kipua raportoi suuri määrä rokoteryhmäläisistä (79 – 86 %), väsymystä (60 – 66 %) ja päänsärkyä (55 – 65 %) oli runsaasti. Vakavaa väsymystä ja päänsärkyä raportoitiin usealla prosentilla koehenkilöistä. Erityisesti vakava päänsärky voi olla yhteydessä taustalla oleviin veritulppiin (katso osio 3.1.3.2). Joten on selvää, että jos tarkastelemme sekä COVID-19:n että rokotteen sivuvaikutuksia, kokonaissairastavuus oli huomattavasti suurempi rokotteen saaneiden ryhmässä kuin lumerokotetta saaneiden.
2.1.3 Epätodennäköisiä väitöksiä ja ristiriitaisuuksia Pfizerin todisteluissa tehokkuudesta. Huomasimme edellä, että Pfizerin rokotteen raportoitu tehokkuus on hyvin vaatimaton, kun se ilmaistaan absoluuttisin termein. Mutta edes tätä matalaa tehokkuutta ei voi hyväksyä sellaisenaan. Tämä tulee selväksi, kun tarkastelemme FDA:n |29| ja EMA:n |30| arviointiraportteja.
2.1.3.1 Yhtäkkinen immuniteetin alkaminen 12 päivää ensimmäisen injektion jälkeen. Avainasemassa oleva kaavio, joka esiintyy molemmissa raporteissa, vertaa COVID-19:n kumulatiivista ilmaantuvuutta (insidenssi) rokoteteryhmässä ja lumeryhmässä. Tämä kaavio, Kuva 9 EMA:n raportissa, on tässä uudelleen kuvattuna, Kuvana 1B. Aina ensimmäisen injektion jälkeiseen 12. päivään saakka kumulatiiviset insidenssit molemmissa ryhmissä seuraavat toisiaan läheisesti. Kuitenkin päivän 12 jälkeen vain lumeryhmään kasaantuu uusia tapauksia tasaiseen tahtiin, kun taas rokoteryhmässä kaavion käyrä putoaa miltei nollaan.
A
B
Kuva 1 Kuvan 7 uudelleen kuvaus (A; neutraloivat vasta-ainetiitterit useina päivinä ensimmäisen injektion jälkeen) ja Kuvan 9 uudelleen kuvaus (B; COVID-19:n kumulatiivinen insidenssi rokote- ja lumeryhmässä) EMA:n arviointiraportista |30|. Huomaa logaritminen y-akseli B:ssä. Katso pohdinnat tekstistä.
Tämä huomionarvoinen havainto antaa ymmärtää, että immuniteetti saavutetaan yhtäkkiä ja yhdenmukaisesti tasan 12. päivänä kaikilla rokotetuilla. Koska toinen rokoteannos annettiin joko 19. päivänä tai myöhemmin ensimmäisen annoksen jälkeen, tämä tarkoittaisi sitä, että yksi injektio riittäisi saamaan aikaan täyden immuniteetin. Tätä johtopäätöstä ei kuitenkaan lainkaan esitetä, ja itse asiassa Pfizer ei esitä mitään dataa koehenkilöistä, jotka saivat vain yhden injektion.
Äkillisen täyden immuniteetin alkaminen 12 päivää ensimmäisen antigeenille altistamisen jälkeen ei ole biologisesti lainkaan uskottava tulos. Tyypillisesti immuniteetti kehittyy hitaammin ja asteittain; ja sellaisen kuvan antaa myös EMA:n raportin Kuva 7 (tälle samaiselle rokotteelle BNT162b2), joka on uudelleen kuvattuna täällä Kuvana 1A. Kuva näyttää SARS-CoV-2:ta neutralisoivien vasta-aineiden määrän kasvun ajan funktiona ensimmäisen rokoteinjektion jälkeen.

Neutralisoivien vasta-aineiden tuotannon käynnistyminen on Pfizerin rokotteen ilmoitettu tarkoitus. Yleisesti ottaen, vasta-aineet ovat proteiinimolekyylejä, joita immuunijärjestelmämme tuottaa, kun se havaitsee antigeenejä – makromolekyylejä, joita ei tavata omassa kehossamme. Nämä antigeenit ovat usein osia tartuntavaarallisista mikrobeista, esim. viruksista. Vasta-aine kiinnittyy tiettyyn antigeenin pinnalla olevaan osaan; tätä osaa kutsutaan kyseessä olevan vasta-aineen epitoopiksi. Virusinfektioiden kontekstissa, vasta-aineet voivat olla neutralisoivia tai ei-neutralisoivia. Neutralisoiva vasta-aine tunnistaa virukselle elintärkeän epitoopin, esimerkkinä epitooppi, joka luo yhteyden pintareseptorimolekyyliin isäntäsolussa, jonka sisälle viruksen tulee päästä kyetäkseen kopioitumaan. Ei neutralisoiva vasta-aine yksinkertaisesti tunnistaa pintaepitoopin, jolla ei ole mitään elintärkeää vaikutusta viruksen tartuntavaarallisuuteen.
Kun otamme huomioon edellä mainitut asiat, olisi luultavaa, että veren neutralisoivien vasta-aineiden tason tulisi heijastaa virukselle saavutetun kliinisen immuniteetin astetta, tätä emme kuitenkaan näe Kuvassa 1A. 21. päivänä ensimmäisen injektion jälkeen, eli yhdeksän täyttä päivää väitetyn äkillisen täyden immuniteetin alkamisen jälkeen, neutralisoivien vasta-aineiden määrä veressä on tuskin lainkaan noussut taustatason yläpuolelle. Maksimaalinen neutralisoivien vasta-aineiden taso havaitaan vasta 28 päivää ensimmäisen injektion jälkeen, jolloin suurin osa koehenkilöistä olisi jo saanut toisen injektion. Sellulaarisen (T-solut) immuniteetin kehittymistä ajan myötä ei ollut selvitetty, mutta kun todisteet vastakkaisesta puuttuvat, voidaan olettaa sen muistuttavan vasta-aineiden vastetta.
On hyvin vaikeaa sovittaa yhteen näitä kahta vastakohtaista havaintoa; täyden kliinisen immuniteetin äkillistä alkamista 12. päivänä ensimmäisen injektion jälkeen ja neutralisoivien vasta-aineiden ilmestymistä vasta viikkoja myöhemmin. Ja silti arvioijat sekä EMA:sta että FDA:sta eivät näytä olleen kiinnostuneita ongelmasta.
2.1.3.2 Pfizerin dokumentaatio on ristiriitaista COVID-19:n insidenssistä rokotuksen jälkeen. Taulukko 1 listaa niiden koehenkilöiden prosenttiosuudet rokoteryhmässä ja lumeryhmässä, joilla ei ollut mitään merkkejä SARS-CoV-2-infektiosta ennen ensimmäistä annosta (päivä 0) ja vastaavasti 14 päivää toisen annoksen jälkeen. Eroista näiden kahden ajankohdan välillä saamme selville, että koehenkilöiden testeistä 7.5 % rokoteryhmässä ja 8 % kontrolliryhmässä muuttuivat negatiivisista positiivisiksi – tarkoittaen sitä, että koehenkilöt olivat saaneet tartunnan – näiden kahden ajankohdan välissä. FDA:n arviointiraportin |29| mukaan, toinen annos annettiin noin 21 päivää ensimmäisen jälkeen vaikka kaikki koehenkilöt, jotka olivat saaneet sen päivien 19 ja 42 välissä ensimmäisen injektion jälkeen, oli sisällytetty arvioon. Jos valitsemme päivän 35 ensimmäisen injektion jälkeen summittaiseksi vertauskohdaksi, näemme Kuviosta 1B, että kumulatiivinen insidenssi päivien 0 ja 35 välissä on enemmän kuin kaksi kertaa korkeampi lumeryhmässä kuin rokoteryhmässä; mutta Taulukosta 1 näemme, että se on suurin piirtein sama. Lisäksi molemmissa ryhmissä luvut ovat huomattavasti korkeammat taulukossa kuin kuviossa.
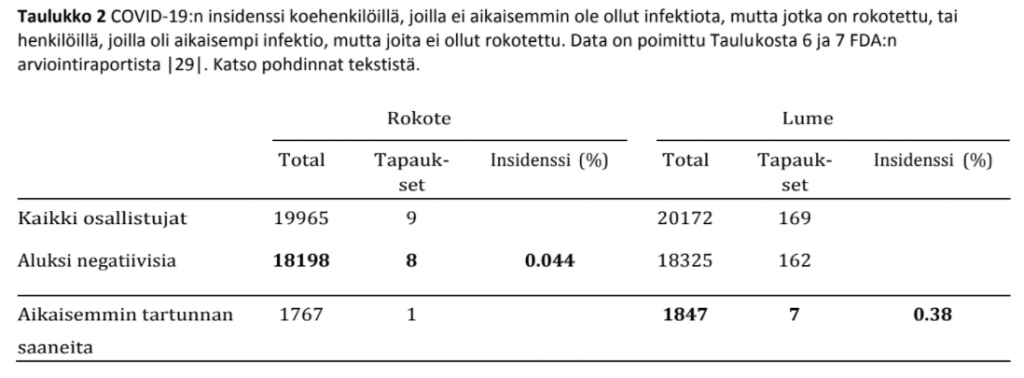
Näitä kahta eri dataa ei voi sovittaa yhteen; yhden on oltava virheellinen. Kuten aikaisemmin pohdimme, äkillinen immuniteetin alkaminen kuten Kuviossa 1B annettiin ymmärtää, ei ole biologisesti uskottavaa, ja niinpä on mitä todennäköisintä, että tämä data on väärennetty.
2.1.3.3 Pfizerin data antaa ymmärtää, että rokotus suojaa COVID-infetiolta tehokkaammin kuin aikaisempi virusinfektio. Voimme myös tarkastella Pfizerin ilmoittamaa dataa vertaamalla rokotteen antamaa immuniteettia siihen, jonka aikaisempi luonnollinen virusinfektio antaa. Kaikki relevantti data on koottu Taulukkoon 2. Raportoidut 8 COVID-19-tapausta rokotetuilla koehenkilöillä, joilla oli aluksi negatiivinen testitulos virukselle, antaa insidenssiksi 0.044 %. Pfizer ilmoittaa myös 7 tapausta, joilla oli aluksi positiivinen testi, mutta joita ei ollut rokotettu. Koska tämä ryhmä on huomattavasti pienempi, saadaan näistä 7 tapauksesta melkein yhdeksänkertainen insidenssi (0.38 %).
On yleisesti tiedossa, että rokotteilla saavutetaan parhaimmillaan, mutta ei ylitetä luonnollisen infektion aikaansaamaa immuniteettia. Hiljattain on raportoitu hyvin vankka immuniteetti aikaisemman luonnollisen SARS-CoV-2-infektion jälkeen |10|; tutkimuksessa ei havaittu yhtäkään COVID-19-infektiota 1359 ei-rokotetun koehenkilön joukossa. Myös laajat laboratoriotutkimukset ovat vahvistaneet vankan infektion jälkeisen immuniteetin |11|. Täten yllä kuvattu analyysi vahvistaa taas kerran, että Pfizerin raportoimiin koetuloksiin ei voi luottaa. Se, että FDA ja EMA eivät panneet merkille näitä epäjohdonmukaisuuksia, luo myös epäluottamusta niiden arvosteluprosessin perusteellisuuteen ja integriteettiin.
2.2 Mitä evidenssiä vielä puuttuu? Olemme jo maininneet Pfizerin kliinisissä kokeissaan käyttämän päätetapahtuman harhaanjohtavan ja keksityn luonteen – nimittäin sen, että COVID-19-”tapausten” määrä perustuu vain positiiviseen PCR-testitulokseen yhdessä yhden tai useamman, enimmäkseen ei tunnusomaisen kliinisen oireen listalta otetun oireen kanssa. Meidän tulee siis kysyä onko rokotteesta mitään olennaista lisähyötyä väitettyjen – yllä tarkasteltujen ja mitä ilmeisimmin väärennettyjen – ”triviaalien” tapausten vähenemisen lisäksi.
2.2.1 Vakavan sairauden ja kuolleisuuden (mortaliteetin) ennaltaehkäiseminen. FDA:n raportin sivulla 48 on yhteenveto tästä kysymyksestä seuraavasti: ”Tarvittaisiin suurempi määrä henkilöitä, joilla on korkea riski saada COVID-19, ja korkeampi sairauskohtausten määrä, jotta voitaisiin vahvistaa rokotteen tehokkuus kuolleisuutta vastaan.”
Huomaamme, että tämä sitaatti ei vain vastaa kieltävästi esitettyyn kysymykseen vaan se myös kokonaan mitätöi tämän kokeellisen rokotteen hätäkäytön auktorisoimiseksi luodun verukkeen. Jos 40,000 koehenkilön kokeessa fataalien lopputulosten määrä on liian pieni havaitsemaan mitään hyötyä rokotteesta, niin kaiketi sellaista ”hätätilaa”, joka oikeuttaisi ne vakavat riskit ja samanaikaiset haitat, jotka johtuvat tästä ja muista erikoisen kiireesti käyttöönotetuista COVID-19-rokotteista, ei ole olemassakaan. Yhtään kuolemaa ei tapahtunut siteeratussa tutkimuksessa nuorilla |31|; ja kuten jo aikaisemmin huomioimme, tämä tutkimus ei myöskään raportoinut yhtään vakavaa tautitapausta. Näin ollen, tässäkään tietyssä ikäryhmässä ei mitään merkitsevää hyötyä tai hätää ole tullut esiin.
2.2.2 Vaikuttavuus (effectiveness) niiden joukossa, joilla on korkea riski saada COVID-19. Tästä FDA:n raportti sanoo seuraavaa: ”Vaikkakin niiden osallistujien osuus on riittävä turvallisuuden kokonaisarvioimiseksi käsillä olevan seuranta-ajan puitteissa, joilla on korkea riski saada COVID-19, tiettyjen alaryhmien kuten heikentyneen immuniteetin omaavien henkilöiden (esim. HIV/AIDS-potilaat) osuus on liian pieni lopputulosten tehokkuusarviointiin.”
Tämä raportti väistää kysymyksen riskin pienentämisestä niillä, joilla on yleisiä altistavia sairauksia, kuten esimerkiksi krooninen sydän- tai keuhkosairaus. Luonnollisesti kliininen tutkimus nuorilla |31| on täysin hedelmätön tässä yhteydessä. Kaiken kaikkiaan, Pfizerin kliiniset tutkimukset eivät ole esittäneet
mitään todistusaineistoa, joka todistaisi kliinistä hyötyä niille, joilla on korkea riski saada vakava COVID-19- infektio.
2.2.3 Vaikuttavuus COVID-19-taudin pitkäaikaisvaikutuksia vastaan. FDA:n raportin tuomio on seuraava: ”Lisäarviointeja tarvitaan määrittämään rokotteen vaikutusta COVID-19:n pitkäaikaisvaikutusten ennaltaehkäisyyn, tähän tulisi sisällyttää dataa kliinisistä kokeista ja rokotteen käytöstä auktorisoinnin jälkeen.” Toisin sanoen kliiniset kokeet eivät tarjonneet sellaista evidenssiä.
2.2.4 Tarttuvuuden vähentäminen. Tähän asiaan liittyen FDA sanoo ainoastaan: “Tarvitaan lisätutkimuksia sisällyttäen dataa kliinisistä kokeista ja auktorisoinnin jälkeisestä rokotteen käytöstä arvioidaksemme rokotteen tehoa viruksen eritykseen ja tarttumiseen, erityisesti henkilöillä, joilla on oireeton infektio.” Suoraan sanottuna, ei ole olemassa todistusaineistoa siitä, että tarttuvuus vähenisi, ja itse asiassa kokeita ei ollut edes suunniteltu todistamaan tai kumoamaan kyseistä vaikutusta.
2.2.5 Suojan pituus. FDA:n raportti asiallisesti tuo julki (s. 46), että ”kun väliaikaisella ja lopullisella analyysillä on rajallinen seuranta-aika, ei ole mahdollista arvioida pitkäkestoista tehoa pidempään kuin kaksi kuukautta.” Vaikka valitsisimme uskoa, että jotakin tehoa tulee esiin kahden kuukauden tutkimusjakson aikana, näin lyhyt suojelevan vaikutuksen pituus ei oikeuta riskejä, jotka liittyvät rokotukseen.
2.2.6 Riittämättömät ponnistelut optimaalisen annoksen määrittämiseksi. Kuvio 1A näyttää, että neutralisoivien vasta-aineiden taso on käytännössä sama rokotteen (mRNA) annoksilla 20µg ja 30µg. Tämä herättää kysymyksen, miksi läpi tutkimuksen käytettiin korkeampaa annosta – eikä vain aikuisilla, joita tutkimalla tämä data oli saatu, vaan myös lapsilla, joilla pienemmän kehomassan vuoksi voisi olettaa pienemmän annoksen riittävän. Lisäksi, data Kuviosta 1B antaa ymmärtää, että jo ensimmäisen annoksen jälkeen saavutetaan täysi immuniteetti; toisen annoksen antaminen ei muuta tahtia, jolla uusia tapauksia kertyy rokoteryhmässä, ja sillä ei siten selvästikään ole merkitystä immuniteettia ajatellen. Tämä antaisi ymmärtää, että yhden annoksen -ohjelmaa olisi tullut arvioida, mikä olisi vähentänyt haittavaikutusten kaikenkattavaa todennäköisyyttä.
2.2.7 Yhteenveto. Pfizerin kliiniset kokeet eivät todista, että rokotteesta olisi mitään hyötyä kliinisesti oleellisiin päätetapahtumiin. Tämä pätee kaikkiin testattuihin ikäryhmiin ja erityisesti myös nuoriin.
3 Pfizerin COVID-19-rokote ei ole turvallinen.
3.1 Mitä todistusaineisto näyttää? Comirnatyn (BNT162b2) kuten myös muiden COVID-19-rokotteiden kliiniset kokeet vietiin kiireellä läpi hyvin lyhyessä ajassa; tämä on tarkoittanut sitä, että asiallisia turvatoimenpiteitä niiden turvallisuuden takaamiseksi ei ole tehty. Silti eläinkokeet, joita tehtiin ennen kliinisten kokeiden alkamista, antoivat syytä odottaa vakavaa toksisuutta. Valitettavasti tämä asia on käytännössä täysin haudattu sen jälkeen, kun massarokotukset alkoivat.
3.1.1 Prekliininen data eläinkokeista nostaa esiin kaksi vakavaa haittaa.
Comirnaty, kuten kaikki muutkin geeniperäiset COVID-19-rokotteet aiheuttavat eläimissä tehdyissä tutkimuksissa (in vivo) yhden tietyn SARS-CoV-2:n proteiinin ilmentymisen – nimittäin nk. piikkiproteiinin, joka sijaitsee viruspartikkelin pinnalla. Piikkiproteiini välittää viruspartikkelin ensimmäisen kiinnittymisen isäntäsoluun ja myös sitä seuraavan viruksen sisäänpääsyn soluun. Comirnaty-rokotteen avainidea on seuraava:
1. synteettinen mRNA, joka koodaa piikkiproteeinia kompleksoidaan neutraalien ja kationisten (positiivisesti varautuneiden) synteettisten lipidien kanssa, jotka ryhmittyvät yhteen lipidinanopartikkeleiksi (LNP);
2. injektion jälkeen LNP:t edesauttavat mRNA:n pääsyä isäntäsoluihin, missä mRNA aiheuttaa piikkiproteiinin synteesin;
3. piikkiproteiini ilmenee isäntäsolujen pinnalla ja aikaansaa immuunireaktion itseään vastaan.
Immuunireaktioon piikkiproteiinia vastaan kuuluu sekä vasta-aineita, jotka saattavat olla, tai eivät ole, neutralisoivia (katso osio 2.1.3.1), ja T-lymfosyyttejä (T-solut). Jotkut näistä T-soluista ovat sytotoksisia eli tappaja-T-soluja, joiden tehtävänä on tappaa kehon viruksesta infektoituneet solut. Vaikka tämä rokotusstrategia saattaa näyttää paperilla hyvältä, siihen sisältyy useita haittapuolia ja riskejä. Näitä nousee esiin sekä lipidiseoksesta että piikkiproteiinista, joilla kummallakin on tiedettyjä toksisia toimintoja.
3.1.1.1 Piikkiproteiinin toksiset ja hyytymistä lisäävät toiminnot. Vakavaan kliiniseen COVID-19-tautiin kuuluu usein veritulppien muodostumisen patologinen aktivoituminen |32|. Piikkiproteiinin keskeinen rooli tässä komplikaatiossa tunnistetaan |33|. Erityisesti tiedetään ainakin kaksi eri mekanismia, jotka triggeröivät veren hyytymistä:
1. Jos piikkiproteiinia ilmenee verisuonten endoteelisoluissa – verisuonten sisin solukerros – silloin immuunireaktio piikkiproteiinia vastaan voi tuhota nämä solut, ja siitä seuraava verisuonivaurio aktivoi veritulppien syntymistä. Tähän immuunireaktioon voi kuulua tappaja-T-soluja, mutta myös vasta-aineita, jotka aktivoivat komplementtijärjestelmän ja muut immuuni-efektori-mekanismit.
2. Piikkiproteiinit, jotka syntyvät verenkierrossa tai jotka päätyvät verenkiertoon sen jälkeen, kun ovat syntyneet jossain muualla kehossa, voivat suoraan kiinnittyä verihiutaleisiin (trombosyytteihin) ja aktivoida niitä. Tämä voi taas saada aikaan veritulppien muodostumista.
Kakkoskohdan mekanismi on merkityksellinen, koska siihen ei kuulu immuunireaktiota; joten se voidaan triggeröidä heti jopa niissä henkilöissä, joilla ei ole aikaisemmin olemassa olevaa immuniteettia. Ensimmäisen kohdan mekanismi on tehokkain niillä henkilöillä, joilla jo on immuniteetti piikkiproteiinia vastaan, joko virusinfektion tai aikaisemman rokoteinjektion vuoksi. Huomaa, että soluvaurion taustalla oleva mekanismi toimii myös muissa kudoksissa – mistä tahansa solusta, joka ilmentää piikkiproteiinia, voi täten tulla immuunireaktion kohde.
Koska Comirnaty ja muut geenipohjaiset rokotteet saavat aikaan aktiivisen ja siten potentiaalisesti toksisen piikkiproteiinisynteesin, on tärkeää ymmärtää, miten tämä proteiini leviää kehossa. Toksisuus saattaisi olla rajallista, jos rokote ja siten myös piikkiproteiinisynteesi pysyisivät vain injektioalueella, lihaskudoksessa verenkierron ulkopuolella. Toisaalta, jos rokote joutuisi verenkiertoon, olisi odotettavissa piikkiproteiinien ilmaantuminen verisuoniin ja veritulppien aktivaation aiheuttama toksisuus.
3.1.1.2 Rokotteen leviäminen eläinkokeissa. Kuinka ollakaan, rokote todellakin ilmaantuu verenkiertoon hyvin nopeasti intramuskulaarisen injektion jälkeen. Tutkimuksissa, jotka Pfizer ilmoitti Japanin terveysviranomaisille |34|, rotille annettiin valerokotenäyte. Tämä materiaali oli kemiallisesti Comirnatyn kaltainen, mutta siinä oli mRNA-molekyyli, joka koodasi helposti jäljitettävän, ei-toksisen malliproteiinin (lusiferaasi) SARS-CoV-2-piikkiproteiinin sijasta.
Lipidiseos, jota käytettiin muodostamaan LNP:t, oli täysin sama kuin Comirnatyssa. Yksi seoksen lipideistä varustettiin radioaktiivisella merkkiaineella, mikä mahdollisti näytteen kehossa leviämisen jäljittämisen ja määrittämisen sensitiivisesti ja tarkasti. Tehtiin useita huomionarvoisia havaintoja:
1. Radioaktiivinen lipidi ilmestyi nopeasti verenkiertoon. Pitoisuus veriplasmassa oli huipussaan kahden tunnin jälkeen; mutta jo 15 minuuttia kokeen alkamisesta plasmapitoisuus oli saavuttanut 45 % maksimaalisesta arvostaan.
2. Hyvin korkeat radioaktiivisen lipidin pitoisuudet kertyivät maksaan, pernaan, lisämunuaisiin, ja munasarjoihin.
3. Verrattain matalat pitoisuudet kertyivät keskushermostoon (aivoihin ja selkäytimeen). 4. mRNA:n koodaaman malliproteiinin esiintymistä tutkittiin vain maksassa, missä se oli helposti havaittavissa.
3.1.1.3 Rokotteen verenkiertoon pääsyn mekanismi. Ottaen huomioon, että mRNA:lla, johon sisältyy kompleksisesti sidottuja lipidinanopartikkeleita, on melko suuri molekyylikoko, meidän tulee kysyä, miten se onnistui pääsemään verenkiertoon niin nopeasti. Intramuskulaarisen injektion jälkeen valtaosan rokotteesta tulisi joutua solujen väliseen tilaan, eli verisuonten ulkopuoliseen tilaan. Tämä tila on erotettu intravaskulaarisesta tilasta (verenkierrosta) hiussuoniesteellä, joka päästää lävitseen vain pieniä molekyylejä kuten happea tai glukoosia (veren sokeri), mutta on läpäisemätön suurille molekyyleille kuten plasmaproteiineille; ja rokotepartikkelit ovat jopa näitäkin suurempia.
Solujen välisen tilan neste poistuu jatkuvasti imusuonten kautta; kaikki imuneste (lymfa) päätyy loppujen lopuksi verenkiertoon rintatiehyen kautta. Partikkelit, jotka ovat liian suuria läpäisemään hiussuoniesteen voivat lopulta päästä verenkiertoon tämän lymfakierron kautta. Tämä prosessi on kuitenkin tuntuvasti hitaampi |35| kuin mitä havaittiin mallirokotteen kohdalla. Meidän täytyy siis kysyä olisiko mallirokote rikkonut hiussuoniesteen ja saanut siten pääsyn verenkiertoon. Samanlaisia lipidiseoksia, kuin mitä on käytetty Pfizerin rokotteessa, on käytetty kokeellisesti aiheuttamaan veri-aivo-esteen läpäisy suonensisäisen injektion jälkeen |36|. Veri-aivo-estettä voi kuvata tavallisen hiussuoniesteen ”vahvistetuksi versioksi” – jos se voidaan rikkoa, voimme odottaa, että sama voi tapahtua myös tavalliselle hiussuoniesteelle. Intramuskulaarisen injektion jälkeinen lipidinanopartikkelien (LNP) korkea paikallinen pitoisuus edistää edelleen esteen rikkoutumista. Tämän tuloksena suuri määrä rokotetta tulee ilmestymään verenkiertoon pikatilauksena. Veritulppiin liittyvät komplikaatiot ovat siis odotettavissa.
3.1.1.4 Muita merkkejä LNP-toksisuudesta. Ehdotettu lipidinanopartikkelien aikaansaama hiussuoniesteen hajoaminen tarkoittaa sytotoksista vaikutusta endoteelisoluissa, jotka muodostavat ainoan hiussuonien seinämien sellulaarisen elementin. Lipidinanopartikkelien sytotoksiset vaikutukset ovat myös ilmiselviä tutkittaessa injektiopaikan vaurioituneita lihassäikeitä |30, s. 49| ja vaurioituneita maksasoluja |30, s. 46|. Huomioi myös, että samaa dataa on saatu malli-mRNA:sta, joka koodaa oletettavasti ei-toksista lusiferaasi entsyymiä. Näin ollen, nämä sytotoksiset toiminnot eivät johdu mistään piikkiproteiinin suorasta toiminnasta. Soluvaurion immunologista komponenttia ei voida kokonaan sulkea pois, mutta ei ole todennäköistä, että se olisi hallitseva tässä tapauksessa sillä lusiferaasia, toisin kun piikkiproteiinia, ei kuljeteta solun pinnalle.
3.1.1.5 Tiettyihin elimiin kertymisen mekanismit. Rokotteen kertymisen suuri määrä maksaan ja pernaan viittaa makrofagisolujen toimintaan. Makrofageja on runsaasti molemmissa elimissä, ja niiden tehtävänä on ei-toivottujen jätteiden poisvienti. Kertyminen lisämunuaisiin, munasarjoihin ja myös maksaan viittaa lipoproteiinien rooliin soluun sisäänpääsyssä näissä elimissä. Lipoproteiinit ovat komplekseja, jotka muodostuvat lipideistä ja tietyistä proteiinimolekyyleistä (apolipoproteiinit), jotka toimivat lipidien kantajina verenkierrossa. Maksalla on yleisesti keskeinen rooli lipidien ja lipoproteiinien aineenvaihdunnassa, kun taas lisämunuaiset ja munasarjat käyttävät lipoproteiineja saadakseen kolesterolia, jota ne sitten muuntavat omiksi steroidihormoneikseen. On hyväksytty ajatus, että lipoproteiineilla on rooli lipidinanopartikkelien siirtämisessä ja soluun sisään ottamisessa |37|. Odotettavissa on siis, että muutkin elimet, joilla on suuri lipoproteiinien sisäänotto voivat vahingoittua vastaavanlaisesti. Näihin kuuluvat etenkin istukka, joka kuten myös munasarjat tuottaa suuria määriä steroidihormonia (progesteronia), ja maitoa erittävät rintarauhaset, jotka hankittuaan liporoteiinien sisältämän kolesterolin erittävät sitä rintamaitoon.
3.1.1.6 Lipidin sisäänoton ja mRNA:n ilmenemisen korrelaatio. Kyseessä olevassa kokeellisessa tutkimuksessa maksan havaittiin ilmentävän mRNA:ta, jolla on kytkös lipidinanopartikkeleihin (katso |30|, osio 2.3.2). Kuten yllä on mainittu, mRNA, jota käytettiin tässä tutkimuksessa, koodasi ”tulikärpäs”- entsyymiä lusiferaasia, joka on juuri se proteiini, joka saa nämä eläimet kiiltämään pimeässä. Nisäkkäiden kudoksissa, joissa tämä entsyymi tulee ilmenemään, hohtaa luminisenssi siinä suhteessa, miten paljon lusiferaasiproteiinia kudokset tuottavat. Luminisenssin mittaukset eivät ole kuitenkaan kovin herkkiä, mikä lienee syynä siihen, että Pfizer teki niitä vain maksassa mutta ei muissa pienemmissä elimissä. Koska meillä ei ole todisteita vastakkaisesta, meidän täytyy olettaa, että korrelaatio tehokkaan LNP:n sisäänoton ja mRNA:n ilmenemisen välillä maksassa sopii myös muihin elimiin. Jos rahti-mRNA koodaa piikkiproteiinia, silloin nämä elimet altistuvat piikkiproteiinin toksisuudelle, ja sitä vastaan suunnatulle immuunireaktiolle suhteessa LNP:n ja mRNA:n sisäänoton tasoon.
3.1.1.7 Potentiaaliset riskit hedelmällisyydelle ja rintaruokituille vastasyntyneille. Korkea piikkiproteiinin ilmeneminen munasarjoissa nostaa esiin sen mahdollisuuden, että elin saattaa vahingoittua merkittävästi. Tällä olisi mahdollisia seuraamuksia hedelmällisyyteen. Rokotteen kerääntyminen rintarauhasen soluihin avaa kaksi mahdollista tapaa, joilla se voisi olla toksista imeväiselle lapselle: ensinnäkin, piikkiproteiinin esiintyminen ja sen eritys rintamaitoon, ja toiseksi, rokotteen suuren määrän siirtyminen maitoon. Rintarauhaset ovat apokriinisia rauhasia, mikä tarkoittaa sitä, että ne erottavat ja vapauttavat osan omasta solulimastaan maitoon; joten kaikki, mikä on päässyt solulimaan saattaa myös päästä rintamaitoon. Tässä yhteydessä on syytä huomata, että sekä VAERS-tietokanta että EU:n lääkkeiden haittavaikutusrekisteri (EudraVigilance) raportoivat rintaruokittujen vastasyntyneiden kuolleisuudesta äitiensä rokotusten jälkeen (katso osio 3.1.3.6).
3.1.1.8 Pfizerin epäonnistuminen prekliinisten tutkimusten selvien riskien selvittämisessä. Kaikki yllä kuvatut riskit on osoitettu toteen sen jälkeen, kun rokotteet on julkistettu, poikkeuksena hedelmällisyyteen liittyvät riskit, joita ei yksinkertaisesti voida arvioida niin lyhyessä aikajaksossa, kuin mitä rokotteet ovat olleet olemassa. Kaikki riskit löytyvät raportoituina eri haittavaikutusrekistereistä (katso osio 3.1.3). Painotamme jälleen, että jokainen näistä riskeistä voisi johtua siteeratusta rajoitetusta määrästä prekliinistä dataa, jota ei ollut tarkemmin arvioitu asianmukaisilla perusteellisilla seurantatutkimuksilla. Nimenomaan kliinisissä kokeissa ei monitoroitu mitään laboratoriomuuttujia, jotka olisivat voineet antaa tietoa näistä esim. veren hyytymiseen liittyvistä (esim. D dimeeri/trombosyytit) tai maksavaurioon liittyvistä (esim. glutamyylitransferaasi) riskeistä.
3.1.2 Valmistusprosessiin liittyvä kontaminaatio. BNT162b2:n kaupallisen mittakaavan valmistusprosessi aiheuttaa useita kontaminaatioita, jotka saattavat vaarantaa rokotteen turvallisuuden ja tehon. Tiivistääksemme mainitsemme vain kaksi tällaista epäpuhtautta.
3.1.2.1 Kontaminaatio bakteerien DNA:sta. mRNA:ta valmistetaan in vitro käyttämällä DNA-mallinetta, joka puolestaan on peräisin bakteerisoluista. Tämä DNA poistetaan jälkikäteen tiettyjen vaiheiden kautta, joiden teho ei ole täydellinen, ja tämä kyllä tunnustetaan EMA:n raportissa (sivut 17 ja 40). Kontaminoivan DNA:n injektointi rokotteen mukana saattaa upottaa sen isäntäsolun genomiin ja aiheuttaa potentiaalisesti vahingoittavia mutaatioita. Bakteeri- DNA myös edistää tulehdusta ei-spesifisesti.
3.1.2.2 Lipidiepäpuhtaudet. EMA:n raportissa huomioidaan myös rokotteen lipidiaineosien synteesissä syntyneitä epäpuhtauksia (s. 24):
Lipideihin liittyviä epäpuhtauksia on havaittu joissakin hiljattain valmistetuissa lopputuotteen valmiste-erissä, vastaten ALC-0315 lipidieriä. Perustuen saatavilla olevaan tietoon, ALC-0315- apuaineen laatua on pidetty hyväksyttävänä sillä ehdolla, että tiettyjä epäpuhtauksia lopputuotteessa arvioidaan edelleen.
Ottaen huomioon, että synteettistä lipidiä ALC-0315 ei koskaan aikaisemmin ole käytetty ihmisillä, ei ole olemassa järkevää empiiristä perustaa epäpuhtauksien ”hyväksyttävälle” tasolle. Lisäksi näyttää siltä, että kontaminoivia lajeja ei ole edes tunnistettu. EMA:n mielivaltainen tavallisen hyväksymisreitin kiertävä todistamattoman rokoteaineosan tuntemattomien kontaminanttien hyväksyminen on täysin sopimatonta.
3.1.3 Haittatapahtumat rokotusten alkamisen jälkeen. Rokotteiden käyttöönoton jälkeen suuri määrä haittatapahtumia on ilmoitettu rekisterivirastoihin ympäri maailmaa. Keskitymme tässä kahteen virastoon, nimittäin USA:n rokotehaittatapahtumien raportointijärjestelmään (VAERS) ja EU:n lääkehaittatapahtumien monitorointijärjestelmään (EudraVigilance). Kaikki alla olevat luvut ovat päivän 21.5.2021 lukuja, jos ei toisin ole mainittu.
3.1.3.1 COVID-rokotteisiin liittyvät kuolemantapaukset. Vain viidessä kuukaudessa rokotusten alkamisen jälkeen on EudraVigilance kerännyt 12,886 ilmoitusta kuolemista liittyen COVID-19-rokotteisiin, joista Pfizerin rokote aiheutti melkein puolet (6,306). Samassa aikajaksossa on VAERS:iin tullut kaiken kaikkiaan 4,406 ilmoitusta kuolemista; joista 91 % liittyi mRNA-rokotteisiin, joista Pfizerin osuus oli 44 % ja Modernan 47 %.
On mahdotonta tietää kuinka suuri osuus kaikista rokotuksen jälkeisistä kuolemista tulee itse asiassa ilmoitetuksi kumpaankaan virastoon. Huomattavaa on kuitenkin se, että ne 4,406 COVID-rokotteeseen liittyvää kuolemaa, jotka ovat kertyneet VAERS:n rekisteriin viimeisten viiden kuukauden aikana, ylittävät kaikkien muiden rokotteiden aiheuttamien kuolemien totaalisen kumulatiivisen määrän koko edeltävän 20 vuoden ajalta. Täten on selvää, että nämä rokotteet ovat ehdottomasti historian kaikkein tappavimpia – mikä oli ennustettavissa, ja kaikki sellaisen taudin vuoksi, jonka kuolleisuusluvut eivät ylitä influenssan kuolleisuuslukuja |1, 38|.
3.1.3.2 Vakavat haittatapahtumat liittyen häiriintyneeseen veren hyytymiseen. Molemmissa tietokannoissa on melkein loppumaton litania diagnooseja, jotka viittaavat patologiseen veren hyytymisen aktivaatioon – sydänkohtaukset, aivohalvaukset, veritulpat aivoissa ja muissa elimissä, keuhkoembolia; mutta myös trombosytopenia ja verenvuoto, jotka liittyvät liialliseen sekä trombosyyttien eli verihiutaleiden että hyytymistekijöiden kulutukseen yleistyneessä suonensisäisessä hyytymisessä. Nämä tautimekanismit aiheuttivat monta yllä mainituista kuolemista; muissa tapauksissa ne aiheuttivat vakavan akuutin sairauden, joka usein jättää jälkeensä vakavan invaliditeetin.
3.1.3.3 Muut vakavat reaktiot. Vakaviin reaktioihin kuuluvat myös epileptiset kohtaukset, muut erityisesti motoriseen kontrolliin liittyvät neurologiset oireet, ja systeeminen tulehdustila, joka vaurioittaa useita elimiä. Lisäksi on hyvin todennäköistä, että monet näistä potilaista tulevat saamaan pitkäaikaisia tai pysyviä jälkiseuraamuksia.
3.1.3.4 Vakavat haitalliset reaktiot nuorilla. Ikäryhmässä 12 – 17 vuotta kaksi kuolemaa, todennäköisesti liittyen Pfizerin rokotteeseen, on jo ilmoitettu EudraVigilance-rekisteriin. Tässä ikäryhmässä oli myös 16 myokardiittitapausta, kaikki pojilla, ja 28 epilepsiatapausta sekä pojilla että tytöillä, ja näistä kolmen raportoitiin olevan hengenvaarallisia. Joukossa oli myös muutamia aivohalvaus-, sydänlihastulehdus- ja vakavan inflammatorisen taudin tapauksia.
Vaikkakin haittatapahtumien määrät ovat paljon alhaisempia kuin aikuisilla, tämä johtuu yksinkertaisesti siitä, että tähän mennessä tässä ikäryhmässä on annettu rokotuksia paljon vähemmän. Jos nuorten systemaattiselle rokotukselle annetaan vihreää valoa, voimme odottaa näiden lukujen nousevan nopeasti samalle tasolle kuin aikuisilla.
3.1.3.5 Keskenmenot. 21.6.2021 mennessä EudraVigilance on listannut 325 keskenmenotapausta rokotetuilla raskaana olevilla naisilla. Vaikkakin on vaikeaa varmistaa kuinka paljon rokotus lisää keskenmenojen määrää, suurimman osan näistä ilmoituksista olivat tehneet terveydenhuollon ammattilaiset, jotka ilmeisesti pitivät yhteyttä rokotteeseen ainakin todennäköisenä. Yksin näiden tapausten määrä antaisi jo riittävästi aihetta keskeyttää rokotukset ja tutkia tarkemmin.
3.1.3.6 Rintaruokittujen vauvojen kuolemat. Vaikka tämä aihe ei suoranaisesti liity tämän oikeusjutun ja asiantuntijanäkemyksen fokuksena olevaan ikäryhmään, on mainitsemisen arvoista, että sekä VAERS- että EudraVigilance-rekistereihin on raportoitu rintaruokittujen lasten kuolemia pian heidän äitinsä saatua Pfizerin rokotteen.
Osiossa 3.1.1.5 tarkastelimme rokotteen kerääntymistä istukkaan ja rintarauhasiin. Raportoidut keskenmenot ja vastasyntyneiden kuolemat viittaavat siihen, että nämä riskit tulee ottaa hyvin vakavasti, ja että Pfizer toimi huolimattomasti, kun ei tutkinut niitä missään raportoiduissa prekliiinisissä tai kliinisissä kokeissaan.
3.2 Puuttuva todistusaineisto. Näimme yllä kuinka merkittäviä positiivisia viitteitä riskeistä laiminlyötiin kliinisissä kokeissa, ja kuinka Pfizerin rokote sai kiireellistetyn hyväksynnän valitettavin, vaikkakin ennalta arvattavin seuraamuksin. Yhtä tuomittavaa on huomiotta jättämisten lista – potentiaalisten riskien, joita olisi tullut tutkia prekliinisissä tai kliinisissä kokeissa, mutta mitä ei koskaan tehty.
3.2.1 Asianmukainen farmakokinetiikka. Osio 3.1.1.2 kuvasi joitakin tutkimuksia, jotka liittyivät korvike- tai mallirokotteen leviämiseen. Vaikka nämä tutkimukset antoivatkin tärkeää ja hyödyllistä tietoa, on huomioitava, että piikkiproteiinin esiintyminen oletetusti reaktiokyvyttömän lusiferaasientsyymin sijasta saattaa vaikuttaa leviämiseen, koska se vaikuttaa häiritsevästi verenkierron eheyteen, esim. veri-aivoesteen toimintaan ja veren hyytymisprosesseihin. EMA:n ja muiden valvojien tehtävänä olisi ollut vaatia, että tällaisia tutkimuksia olisi tehty ja dokumentoitu.
3.2.2 Lääkkeiden yhteisvaikutukset. EMA-raportissa sanotaan (s. 110):
Yhteisvaikutuskokeita toisten rokotteiden kanssa ei ole tehty, mikä on hyväksyttävää, koska on olemassa tarve käyttää rokotetta hätätilanteessa.
Koska on selvää, että COVID-19:n mortaliteetti on alhainen (katso osio 1.1.1) eikä mitään hätätilaa vallitse, tämä argumentti tulee hyljätä harhaanjohtavana.
BNT162b2:n immunosupressiiviset vaikutukset ovat ilmeiset, kun katsotaan veren lymfosyyttien määrän laskua ja tarkastellaan Herpes Zosterin (vyöruusun) kliinistä ilmenemistä rokotetuilla. Vyöruusu saa alkunsa, kun latentti elimistössä oleva varisella-zoster-virus uudelleen aktivoituu |39|. Tämä antaa ymmärtää, että samanaikaisesti annettujen muiden rokotteiden haluttu immuunivaste saattaa olla heikentynyt.
Lisäksi, tutkimuksia yhteisvaikutuksista ei olisi pitänyt rajata vain rokotteisiin vaan laajentaa myös muihin lääkkeisiin. Yksi huolen aihe on kokeellisesti ilmeinen BNT162b2:n maksatoksisuus. Maksa on keskeisessä roolissa monien lääkkeiden metabolisessa inaktivaatiossa ja kehosta poistamisessa; mikä
tahansa häiriö tämän elimen toiminnassa luo välittömästi monia mahdollisuuksia lääkkeiden haitallisille yhteisvaikutuksille.
3.2.3 Genotoksisuus. Mitään tutkimuksia ei ole tehty genotoksisuudesta, joka tarkoittaa ihmisen geneettisen materiaalin vaurioitumista, joka voisi johtaa perinnöllisiin mutaatioihin ja syöpään. EMA:n raportissa (|30| s. 50) tämä oikeutetaan seuraavasti:
Mitään genotoksisuustutkimuksia ei ole tehty. Tämä on hyväksyttävää, koska rokotteen formulaation komponentit ovat lipidejä ja RNA:ta, joilla ei oleteta olevan genotoksista potentiaalia. Luvanhakijan suorittamasta riskiarvioinnista selviää, että näiden apuaineiden (ts synteettisten lipidien) genotoksisuuden riski on kirjallisuuden mukaan hyvin matala.
Tosiasiassa tiedetään, että lipidinanopartikkelit, joita on BNT162b2:ssa, voivat päästä kaikenlaisiin soluihin – tämähän on loppujen lopuksi syy, miksi ne on lisätty tähän rokotevalmisteeseen. Tiedetään myös, että kerran päästyään sisälle soluun, kationiset lipidit häiritsevät mitokondrioiden toimintaa (soluhengitystä) ja aiheuttavat oksidatiivista stressiä, mikä puolestaan johtaa DNA:n vaurioitumiseen. Täytyy myös mainita, että kahta Pfizerin käyttämistä lipideistä – nimittäin kationinen lipidi ALC-0315 ja PEGyloitu lipidi ALC-0159, jotka käsittävät 30 – 50 % ja 2 – 6 % lipidien kokonaismäärästä – ei aikaisemmin ole hyväksytty käytettäväksi ihmisillä. Pfizerin ja EMA:n välinpitämätön asenne uusien ja tähän asti todistamattomien kemikaalien käyttöön lääkkeiden tai rokotteiden valmistuksessa ilman kattavia toksisuus tai genotoksisuustutkimuksia on täysin epätieteellistä ja mahdotonta hyväksyä.
3.2.4 Lisääntymiseen liittyvä toksisuus. Lisääntymiseen liittyvää toksisuutta arvioitiin vain yhdellä lajilla (rotat) ja vain pienellä joukolla eläimiä (21 pesuetta). Todettiin suurempi kuin kaksinkertainen ennen kiinnittymistä tapahtuvien alkioiden menetys, 9.77 % rokoteryhmässä verrattuna 4.09 %:iin kontrolliryhmässä. Sen sijaan, että vain mainittiin |30, s. 50|, että korkeampi arvo pysyi ”historiallisen kontrollidatan vaihteluvälillä”, tutkimuksessa olisi yksiselitteisesti pitänyt mainita, oliko tämä ero tilastollisesti merkittävä vai ei, ja kokeitten määrää olisi pitänyt nostaa varmistamaan vaadittava tilastollinen voima. Sama pätee havaintoihin ”hyvin matalasta vatsahalkion, suun/leuan epämuodostumien, oikeanpuoleisen aorttakaaren, ja kaulan nikamien poikkeavuuksien insidenssistä”. Kaiken kaikkiaan näitä tutkimuksia on riittämättömästi kuvattu ja selvästi myös riittämättömästi toteutettu.
3.2.5 Autoimmuniteetti. Altistuminen rokotteelle lisää soluvaurioita, joita syntyy kationisten lipidien kautta sekä immuunijärjestelmän hyökkäyksestä piikkiproteiinia valmistavia soluja vastaan. Tuhoutumassa olevista soluista vuotaa ulos proteiineja ja muita makromolekyylejä, joita immuunijärjestelmän makrofagit siivoavat pois.
Kun siivousjärjestelmä on ylikuormittunut ylenmääräisen solujen vaurioitumisen ja solukuoleman (apoptoosin) vuoksi, tuhoutuneiden solujen jäänteiden kerääntyminen johtaa krooniseen liialliseen tyypin I interferonin vapautumiseen; tämä puolestaan triggeröi tulehdusta entisestään. Ajan myötä joistakin solujäänteissä olevista makromolekyyleistä tulee vasta-ainemuodostuksen ja autoreaktiivisten sytotoksisten T-solujen aktivaation kohteita – ne alkavat toimia auto-antigeeneinä. Tämä johtaa sitten lisääntyneeseen solujen vaurioitumiseen ja lisääntyneeseen autoantigeenien vapautumiseen – kehittyy autoimmuunisairaus. Tällainen kehitys on erityisen todennäköistä heikentyneen immuniteetin omaavilla ihmisillä tai niillä, joilla on geneettinen alttius (esim. HLA-B27 alleeli) autoimmuunisairauksiin. BNT162b2:n aiheuttamaa autoimmuniteetin riskiä voidaan asiaankuuluvasti arvioida vain pitkäaikaistutkimuksilla; kuten syntyvyyttä tai syöpää tutkittaessa, prekliinisten ja kliinisten tutkimusten hyvin lyhyt tutkimusjakso tarkoittaa sitä, että lennämme sokeina. Pitäisi olla itsestään selvää, että kaikki nämä riskit ovat erityisen vakavia lapsilla, nuorilla ja nuorilla aikuisilla.
3.2.6. Vasta-aineriippuvainen taudin vaikeutuminen. Vaikkakin vasta-aineet periaatteessa suojelevat meitä infektioilta, joissakin tapauksissa ne voivat lisätä taudin vakavuutta. Tätä ilmiötä kutsutaan vasta aineriippuvaiseksi taudin vaikeutumiseksi.
3.2.6.1 Periaate. Osiossa 2.1.3.1 yllä näimme, että vasta-aineet saattavat neutralisoida tai olla neutralisoimatta niitä aktivoineen viruksen. Vaikkakin suurimmassa osassa tapauksia ei-neutralisoivat vasta-aineet ovat harmittomia, joidenkin virusten kohdalla ne voivat itse asiassa pahentaa tilannetta edesauttamalla virusten sisäänpääsyä isäntäsoluun. Tämä tapahtuu, koska immuunijärjestelmän tiettyjen solujen tehtävänä on saada kiinni vasta-ainemerkityt mikrobit ja tuhota ne. Jos viruspartikkelin, johon vasta-aineet ovat kiinnittyneet, saa kiinni tällainen solu, mutta viruspartikkeli ei tuhoudukaan, se saattaakin alkaa monistua tässä solussa. Kaiken kaikkiaan, vasta-aine on silloin vahvistanut viruksen replikaatiota. Kliinisesti tämä vasta-aineriippuvainen taudin vaikeutuminen (antibody-dependent enhancement, ADE) voi aiheuttaa hyperinflammatorisen vasteen (”sytokiinimyrskyn”), joka voimistaa vaurioita keuhkoissa, maksassa ja muissa elimissä.
ADE voi tapahtua sekä luonnollisen infektion että rokotuksen jälkeen, ja sitä on havaittu useisiin virusperheisiin liittyen, esim. Dengue-, Ebola-, RS-virus ja HIV |40|. Tärkeää on, että ADE esiintyy myös koronaviruksilla, erityisesti SARS:ssa, jonka kausatiivinen taudinaiheuttaja on läheistä sukua SARS-CoV-2:lle. Yritykset kehittää rokotteita SARS:ia vastaan epäonnistuivat toistuvasti ADE:n vuoksi – rokotteet saivat aikaan vasta-aineita, mutta kun rokotetut eläimet myöhemmin altistettiin virukselle, ne tulivat sairaammiksi kuin ei-rokotetut kontrollit (katso esim. |41|).
3.2.6.2 SARS-CoV-2 ja ADE. ADE:n mahdollisuus luonnollisen SARS-CoV-2-infektion kuten myös sitä vastaan suunnatun rokotuksen jälkeen, on tunnustettu |42|. Erityisesti piikkiproteiinivasta-aineiden aiheuttaman ADE:n, jonka esiintuloa muut koronaviruskannat ovat vahvistaneet, on vedottu aiheuttaneen taudin vakavuuden poikkeuksellisen maantieteellisen jakautumisen Kiinassa |43|. Kokeellista tutkimusta, joka tarvittaisiin sen osoittamiseen, ei kuitenkaan ole tehty, vaikka pandemian alusta on jo yli vuosi. Joissakin kokeellisissa SARS-rokotteissa ADE:ta voitaisiin lievittää inuliinipohjaisilla adjuvanteilla |44|. Tällainen lähestymistapa voisi olla toteuttamiskelpoinen ADE:n estämiseksi myös COVID-19-rokotteissa, mutta toistaiseksi näyttäisi siltä, että tätä ei ole tutkittu millään olemassa olevista COVID-rokotteista. Myös Pfizer ja säätelevät tahot ovat hyvin selvillä ADE:n riskistä. FDA mainitsee sen ohjeistusdokumentissaan (|29|, s. 44):
Pfizer esitti Farmakovigilanssisuunnitelman (Pharmacovigilance Plan, PVP) valvoakseen turvallisuusongelmia, jotka voisivat liittyä Pfizer-BionTech COVID-19 Rokotteeseen. Rahoittaja tunnisti rokotteisiin liittyvän vaikeutuvan taudin, johon kuuluu rokotteeseen liittyvä vaikeutunut hengitystiesairaus tärkeänä potentiaalisena riskinä.
Tässä termi ”rokotteeseen liittyvä vaikeutunut tauti” viittaa ADE:hen. EMA on myös tunnustanut, että tätä riskiä tulee tutkia edelleen (|30|, s. 141):
Kaikki tärkeät potentiaaliset riskit, jotka saattavat olla spesifisiä COVID-19-rokotteelle (esim. rokotteeseen liittyvä hengitystiesairauden vaikeutuminen) tulisi ottaa huomioon. Hakija on sisällyttänyt VAED/VAERD:n tärkeänä potentiaalisena riskinä ja aikoo tutkia sitä edelleen meneillään olevassa keskeisessä tutkimuksessa ja auktorisoinnin jälkeisessä turvallisuustutkimuksessa.
Kaiken kaikkiaan on selvää, että ADE:n riski on tunnustettu teoria, jota ei kuitenkaan sovelleta käytäntöön. Kun otetaan huomioon runsas todistusaineisto ADE:sta kokeellisilla SARS-rokotteilla, tämä on täysin vastuutonta.
Lähteet:
[1] J. P. A. Ioannidis: Infection fatality rate of COVID-19 inferred from seroprevalence data. Bull. World Health Organ. (2020), BLT.20.265892. url: https://www.who.int/bulletin/ online_first/BLT.20.265892.pdf.
[2] J. P. A. Ioannidis: Reconciling estimates of global spread and infection fatality rates of COVID-19: An overview of systematic evaluations. Eur. J. Clin. Invest. 5 (2021), e133554. pmid: 33768536.
[3] CDC COVID-19 Response Team: Coronavirus Disease 2019 in Children – United States, February 12-April 2, 2020. MMWR. Morbidity and mortality weekly report 69 (2020), 422– 426. pmid: 32271728.
[4] S. Tsabouri et al.: Risk Factors for Severity in Children with Coronavirus Disease 2019: A Comprehensive Literature Review. Pediatric clinics of North America 68 (2021), 321–338. pmid: 33228941.
[5] J. Y. Abrams et al.: Multisystem Inflammatory Syndrome in Children Associated with Severe Acute Respiratory Syndrome Coronavirus 2: A Systematic Review. J. Pediatr. 226 (2020), 45– 54. pmid: 32768466.
[6] P. A. McCullough et al.: Multifaceted highly targeted sequential multidrug treatment of early ambulatory high-risk SARS-CoV-2 infection (COVID-19). Reviews in cardiovascular medicine 21 (2020), 517–530. pmid: 33387997.
[7] C. Bernigaud et al.: Oral ivermectin for a scabies outbreak in a long-term care facility: potential value in preventing COVID-19 and associated mortality. Br. J. Dermatol. 184 (2021), 1207–1209. pmid: 33454964.
[8] Anonymous: WHO advises that ivermectin only be used to treat COVID-19 within clinical trials. 2021. url: https://www.who.int/news-room/feature-stories/detail/whoadvises that-ivermectin-only-be-used-to-treat-covid-19-within-clinicaltrials.
[9] J. Flood et al.: Paediatric multisystem inflammatory syndrome temporally associated with SARS-CoV-2 (PIMS-TS): Prospective, national surveillance, United Kingdom and Ireland, 2020. The Lancet regional health. Europe 3 (2021), 100075. pmid: 34027512. [10] N. K. Shrestha et al.: Necessity of COVID-19 vaccination in previously infected individuals. medRxiv (2021). doi: 10.1101/2021.06.01.21258176.
[11] S. S. Nielsen et al.: SARS-CoV-2 elicits robust adaptive immune responses regardless of disease severity. EBioMedicine 68 (2021), 103410. pmid: 34098342.
[12] A. Grifoni et al.: Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell 181 (2020), 1489–1501.e15. pmid: 32473127.
[13] N. Le Bert et al.: SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 584 (2020), 457–462. pmid: 32668444.
[14] S. Cao et al.: Post-lockdown SARS-CoV-2 nucleic acid screening in nearly ten million residents of Wuhan, China. Nat. Commun. 11 (2020), 5917. pmid: 33219229.
[15] R. Wölfel et al.: Virological assessment of hospitalized patients with COVID-2019. Nature 581 (2020), 465–469. pmid: 32235945.
[16] K. Basile et al.: Cell-based culture of SARS-CoV-2 informs infectivity and safe de-isolation assessments during COVID-19. Clin. Infect. Dis. (2020). pmid: 33098412.
[17] Anonymous: Covid: Secret filming exposes contamination risk at test results lab. 2021. url: https://www.bbc.com/news/uk-56556806.
[18] K. G. Andersen et al.: The proximal origin of SARS-CoV-2. Nat. Med. 26 (2020), 450–452. doi: 10.1038/s41591-020-0820-9.
[19] B. Sørensen et al.: Biovacc-19: A Candidate Vaccine for Covid-19 (SARS-CoV-2) Developed from Analysis of its General Method of Action for Infectivity. QRB Discovery 1 (2020). doi: 10.1017/qrd.2020.8.
[20] B. Sørensen et al.: The evidence which suggests that this is no naturally evolved virus. Preprint (2020). url: https : / / www . minervanett . no / files / 2020 / 07 / 13 / TheEvidenceNoNaturalEvol.pdf.
[21] L. Yan et al.: Unusual Features of the SARS-CoV-2 Genome Suggesting Sophisticated Laboratory Modification Rather Than Natural Evolution and Delineation of Its Probable Synthetic Route. Preprint (2020). doi: 10.5281/zenodo.4028829.
[22] L. Yan et al.: SARS-CoV-2 Is an Unrestricted Bioweapon: A Truth Revealed through Uncovering a Large-Scale, Organized Scientific Fraud. Preprint (2020). doi: 10.5281/zenodo. 4073131.
[23] S. Yang and R. E. Rothman: PCR-based diagnostics for infectious diseases: uses, limitations, and future applications in acute-care settings. Lancet Infect. Dis. 4 (2004), 337–48. pmid: 15172342.
[24] V. M. Corman et al.: Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Euro Surveill. 25 (2020). pmid: 31992387.
[25] Anonymous: Corman-Drosten review report. 2020. url: https://cormandrostenreview. com/.
[26] R. Jaafar et al.: Correlation Between 3790 Quantitative Polymerase Chain Reaction-Positives Samples and Positive Cell Cultures, Including 1941 Severe Acute Respiratory Syndrome Coronavirus 2 Isolates. Clin. Infect. Dis. 72 (2020), e921. pmid: 32986798.
[27] F. M. Liotti et al.: Assessment of SARS-CoV-2 RNA Test Results Among Patients Who Recovered From COVID-19 With Prior Negative Results. JAMA internal medicine 181 (2020), 702–704. pmid: 33180119.
[28] J. Bullard et al.: Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples. Clin. Infect. Dis. 71 (2020), 2663–2666. pmid: 32442256. [29] Anonymous: FDA briefing document: Pfizer-BioNTech COVID-19 Vaccine. 2020. url: https: //www.fda.gov/media/144245/download.
[30] Anonymous: Assessment report/Comirnaty. 2021. url: https://www.ema.europa.eu/ en/documents/assessment-report/comirnaty-epar-public-assessment-report_ en.pdf.
[31] R. W. Frenck et al.: Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents. N. Engl. J. Med. (2021). pmid: 34043894.
[32] R. A. Campbell et al.: Comparison of the coagulopathies associated with COVID-19 and sepsis. Research and practice in thrombosis and haemostasis 5 (2021), e12525. pmid: 34027292. [33] G. H. Frydman et al.: The Potential Role of Coagulation Factor Xa in the Pathophysiology of COVID-19: A Role for Anticoagulants as Multimodal Therapeutic Agents. TH open : companion journal to thrombosis and haemostasis 4 (2020), e288–e299. pmid: 33043235. [34] Anonymous: SARS-CoV-2 mRNA Vaccine (BNT162, PF-07302048) 2.6.4 [Summary statement of the pharmacokinetic study] (Japanese). 2020. url: https://www.pmda.go.jp/drugs/ 2021/P20210212001/672212000_30300AMX00231_I100_1.pdf.
[35] I. C. Kourtis et al.: Peripherally administered nanoparticles target monocytic myeloid cells, secondary lymphoid organs and tumors in mice. PLoS One 8 (2013), e61646. pmid: 23626707.
[36] C. Ye et al.: Co-delivery of GOLPH3 siRNA and gefitinib by cationic lipid-PLGA nanoparticles improves EGFR-targeted therapy for glioma. J. Mol. Med. Berl. 97 (2019), 1575–1588. pmid: 31673738.
[37] R. Dal Magro et al.: ApoE-modified solid lipid nanoparticles: A feasible strategy to cross the blood-brain barrier. J. Control. Release 249 (2017), 103–110. pmid: 28153761. [38] R. B. Brown: Public health lessons learned from biases in coronavirus mortality overestimation. Disaster Med. Public Health Prep. (2020), 1–24. pmid: 32782048.
[39] V. Furer et al.: Herpes zoster following BNT162b2 mRNA Covid-19 vaccination in patients with autoimmune inflammatory rheumatic diseases: a case series. Rheumatology (2021). pmid: 33848321.
[40] S. M. C. Tirado and K.-J. Yoon: Antibody-dependent enhancement of virus infection anddisease. Viral immunology 16 (2003), 69–86. pmid: 12725690.
[41] C.-T. Tseng et al.: Immunization with SARS coronavirus vaccines leads to pulmonary immunopathology on challenge with the SARS virus. PLoS One 7 (2012), e35421. pmid: 22536382.
[42] F. Negro: Is antibody-dependent enhancement playing a role in COVID-19 pathogenesis? Swiss Med. Wkly. 150 (2020), w20249. pmid: 32298458.
[43] J. A. Tetro: Is COVID-19 receiving ADE from other coronaviruses? Microbes and infection 22 (2020), 72–73. pmid: 32092539.
[44] Y. Honda-Okubo et al.: Severe acute respiratory syndrome-associated coronavirus vaccines formulated with delta inulin adjuvants provide enhanced protection while ameliorating lung eosinophilic immunopathology. J. Virol. 89 (2015), 2995–3007. pmid: 25520500.
Lataa tämä teksti pdf-tiedostona:
Asiantuntijalausunto koskien Comirnaty COVID-19-rokotetta lapsille.pdf


